
 ;氯化铵中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在共价键,其电子式为
;氯化铵中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在共价键,其电子式为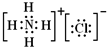 ,故答案为:
,故答案为: ;
;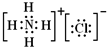 ;
;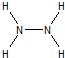 ,
, ;
; ;
; ,
, ;
; ..
..


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、在蔗糖中加入浓硫酸之前先加少量的水 |
| B、浓硫酸遇水放热加速反应的进行 |
| C、产生大量具有刺激性气体 |
| D、整个实验中浓硫酸只体现出脱水性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是制取溴苯的装置,试回答:
如图是制取溴苯的装置,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 |
| B、明矾和漂白粉常用于自来水的净化,但两者的作用原理不相同 |
| C、氯化铁溶液可用于制作印刷电路板是因为其具有较强氧化性,能氧化单质铜 |
| D、“加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是对应的单质分子,而钙、铁则分别指的是对应的钙离子和铁离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清透明的溶液中:K+、Fe2+、NO3-、MnO4- |
| B、使pH试纸呈红色的溶液中:I-、Cl-、ClO-、Na+ |
| C、含有较多的Al3+的溶液中:K+、Ca2+、HCO3-、Cl- |
| D、由水电离出的c(H+)=1×10-12mol/L的溶液中:K+、Na+、Cl-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com