
【题目】下图为光电催化能源化利用CO2制备太阳能燃料的示意图。下列说法不正确的是______
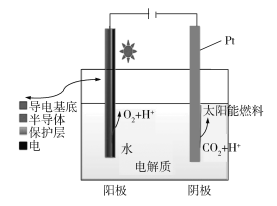
A.阳极反应式为2H2O4e![]() 4H++O2↑
4H++O2↑
B.CO2还原产物可能为CO、HCHO、CH3OH、CH4等
C.阳极、阴极材料互换对制备太阳能燃料影响不大
D.若太阳能燃料为甲醇,则阴极电极反应式为:CO2+6H++6e![]() CH3OH+H2O
CH3OH+H2O
科目:高中化学 来源: 题型:
【题目】常温下,在体积均为20mL、浓度均为0.1mol·L-1的HX溶液、HY溶液中分别滴加同浓度的NaOH溶液,反应后溶液中水电离的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加氢氧化钠溶液体积的关系如图所示。
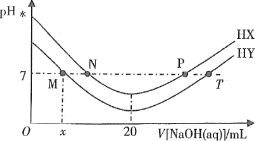
下列推断正确的是
A.HX的电离方程式为HX=H++X-
B.T点时c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常温下用蒸馏水分别稀释N、P点溶液,pH都降低
D.常温下,HY的电离常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验创新小组设计了如图所示的检验Cl2某些性质的一体化装置。下列有关描述不正确的是
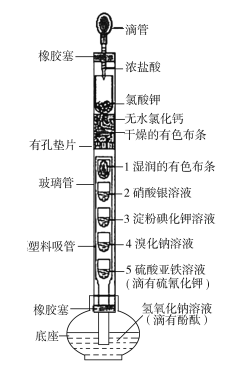
A.浓盐酸滴到氯酸钾固体上反应的离子方程式为5Cl+![]() +6H+===3Cl2↑+3H2O
+6H+===3Cl2↑+3H2O
B.无水氯化钙的作用是干燥Cl2,且干燥有色布条不褪色,湿润的有色布条褪色
C.2处溶液出现白色沉淀,3处溶液变蓝,4处溶液变为橙色,三处现象均能说明了Cl2具有氧化性
D.5处溶液变为血红色,底座中溶液红色消失,氢氧化钠溶液的作用为吸收剩余的Cl2以防止污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是
A.11 g硫化钾和过氧化钾的混合物,含有的离子数目为0.4NA
B.28 g聚乙烯(![]() )含有的质子数目为16NA
)含有的质子数目为16NA
C.将标准状况下224 mL SO2溶于水制成100 mL溶液,H2SO3、![]() 、
、![]() 三者数目之和为0.01NA
三者数目之和为0.01NA
D.含63 g HNO3的浓硝酸与足量铜完全反应,转移电子数目为0.50NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4═2PbSO4+2H2O。正极电极反应式为__,随着反应的进行,正极附近溶液的酸性将__。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu═2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为__,当线路中转移0.4mol电子时,则被腐蚀铜的质量为__g。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为__。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
(4)如图是一种新型燃料电池,以CO为燃料,一定比例的Li2CO3和Na2CO3的熔融混合物为电解质,A极为电源(填“正”或“负”)___极,写出A极的电极反应式:___。
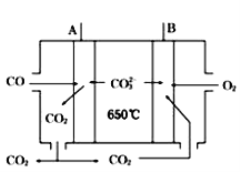
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等。请回答下列问题:
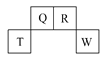
(1)R的原子结构示意图为__。
(2)元素的非金属性(原子的得电子能力):Q___W(填“>”或“<”),Q的最高价氧化物的电子式为___,Q的一种氢化物的相对分子量是氢气相对分子量的36倍,该氢化物可能的结构简式有___。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为___。
(4)原子序数比R多1的元素的一种氢化物能分解出它的另一种氢化物,此分解反应的化学方程式是___。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种。则该含氧酸盐的化学式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同主族元素形成的同类型的化合物,往往其结构和性质相似。下列对化合物碘化磷(PH4I)的叙述错误的是( )
A.它是一种离子化合物
B.这种化合物加热时,可能产生有色气体
C.这种化合物的电子式为: 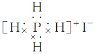
D.这种化合物可以和烧碱发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行如下反应:2SO2(g) +O2(g) ![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达平衡时,可能存在的数据是
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2 mol/L,当反应达平衡时,可能存在的数据是
A. SO2为0.4mol/L
B. SO2为 0.25mol/L
C. SO2、SO3均为0.15mol/L
D. SO3为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ(X)可表示为( )
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率υ(X)可表示为( )
A. υ(NH3)=0.010mol/(L·s)B. υ(O2)=0.0010mol/(L·s)
C. υ(NO)=0.0010mol/(L·s)D. υ(H2O)=0.045mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com