
| A. | 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe | |
| B. | 电池充电时,阴极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O | |
| C. | 电池充电过程中,阴极附近溶液的pH升高 | |
| D. | 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
分析 根据电池的总反应:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2,可以判断出铁镍蓄电池放电时Fe作负极,发生氧化反应,为还原剂,失电子生成Fe2+,最终生成Fe(OH)2,Ni2O3作正极,发生还原反应,为氧化剂,得电子,最终生成Ni(OH)2,电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2,则充电时,阴极发生Fe(OH)2+2e-=Fe+2OH-,阴极附近溶液的pH升高,电池充电时,阳极发生2Ni(OH)2+2OH--2e-=Ni2O3+3H2O.
解答 解:A.反应后产物有氢氧化物,可得电解液为碱性溶液,由放电时的反应可以得出铁做还原剂失去电子,Ni2O3做氧化剂得到电子,即正极为Ni2O3、负极为Fe,故A正确;
B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2,则充电时,阴极发生Fe(OH)2+2e-=Fe+2OH-,故B错误;
C.充电可以看作是放电的逆过程,即阴极为原来的负极,所以电池放电时,负极反应为:Fe+2OH--2e-=Fe(OH)2,所以电池充电过程时阴极反应为Fe(OH)2+2e-=Fe+2OH-,因此电池充电过程中阴极附近溶液的pH会升高,故C正确;
D.充电时,阴极发生Fe(OH)2+2e-=Fe+2OH-,阳极发生2Ni(OH)2+2OH--2e-=Ni2O3+3H2O,故D正确.
故选B.
点评 本题考查二次电池的工作原理,为高频考点,侧重考查学生的分析能力,涉及到原电池和电解池的有关知识,做题时注意根据总反应从氧化还原的角度判断化合价的变化,以得出电池的正负极以及所发生的反应.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
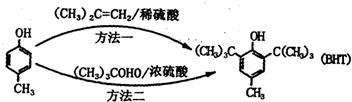
| A. | BHT在水中的溶解度小于苯酚 | |
| B. |  与BHT互为同系物 与BHT互为同系物 | |
| C. | 1molBHT可与含有2molBr2的浓溴水发生取代反应 | |
| D. | 方法一的原子利用率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锌铁制品镀层受损后,铁制品也不容易生锈 | |
| B. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH | |
| C. | 粗铜精炼时,电镀液中的c(Cu2+)保持不变 | |
| D. | 将钢闸门与直流电源的负极相连,可降低钢闸门腐蚀速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将金属A投入B的盐溶液,A溶解说明A的金属性比B的金属性强 | |
| B. | 用干燥洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧,火焰呈黄色,说明该溶液是钠盐溶液 | |
| C. | 合成新型农药可以在元素周期表的金属与非金属交界处区域探寻 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2 ml 5%H2O2和1 mlH2O,向另一支试管中加入2 mL 5%H2O2和1 mLFeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的简单离子半径大于W的简单离子半径 | |
| B. | Z的氧化物对应水化物为强酸 | |
| C. | XW2熔沸点较低,可能是共价化合物 | |
| D. | 工业制Y可以电解熔融的YW3制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com