
| 时间/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)/(mol•L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500 s内NO2的生成速率为2.96×10-3 mol•L-1•s-1 | |
| B. | T1温度下该反应平衡时N2O5的转化率为29.6% | |
| C. | 达到平衡其他条件不变,将容器的体积压缩到原来1/2,则c(N2O5)<5.00mol•L-1 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
分析 A.依据图标数据分析计算500s内N2O5(g)消耗的浓度计算分解率;
B.由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,计算转化率;
C.将容器的体积压缩到原来的$\frac{1}{2}$,各物质的浓度先变为原来的2倍,而加压平衡左移;
D.该反应正反应是吸热反应,升高温度,平衡向正反应移动,平衡常数增大.
解答 解:A.依据图标数据分析计算500s内N2O5(g)消耗的浓度=5.00mol/L-3.52mol/L=1.48mol/L,分解速率=$\frac{.48mol/L}{500s}$=2.96×10-3 mol/(L•s),所以二氧化氮的反应速率=2v(N2O5)=5.92×10-3 mol•L-1•s-1,故A错误;
B.由表中数据可知,T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,c(NO2)=5mol/L,c(O2)=1.25mol/L,转化率为$\frac{5-2.5}{5}$×100%=50%,故B错误;
C.T1温度下,1000s时反应到达平衡,平衡时c(N2O5)=2.5mol/L,达平衡后其他条件不变,将容器的体积压缩到原来的$\frac{1}{2}$,各物质的浓度先变为原来的2倍,而加压平衡左移,则c(N2O5)>5.00 mol•L-1,故C错误;
D.该反应正反应是吸热反应,升高温度,平衡向正反应移动,平衡常数增大,所以温度高,平衡常数大,故D正确;
故选D.
点评 本题考查化学平衡状态判断、化学平衡有关计算、化学平衡影响因素、平衡常数等,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | K+、I-、AlO2-、MnO4- | B. | Na+、S2-、NO3-、SO42- | ||
| C. | Al3+、NH4+、NO3-、F- | D. | K+、Cl-、ClO-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种天然抗癌药物,在一定条件下能发生如下转化
)是一种天然抗癌药物,在一定条件下能发生如下转化
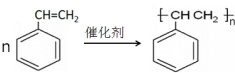 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3溶于氢碘酸溶液中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | 在Cu2O固体中加入足量的稀硫酸:Cu2O+2H+═Cu+Cu2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验操作 | 向MgCl2、AlCl3溶液中(各1mol),逐滴加入NaOH溶液 | 向HCl、MgCl2、AlCl3、NH4Cl溶液中(各1mol),逐滴加入NaOH溶液 | 向NaOH、NaAlO2溶液中(各1mol),逐滴加入HCl溶液 | 向NaOH、Na2CO3混合溶液中(各1mol)滴加稀盐酸 |
| 图象 | 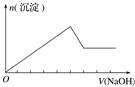 |  | 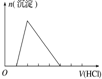 | 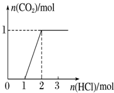 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的主要成分为次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥氨气 | |
| C. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| D. | 它们对应的含氧酸都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 是一种极性分子易溶于水 | |
| B. | 分子中,每个磷原子以3个共价键结合3个磷原子 | |
| C. | 相对分子质量8倍于白磷分子 | |
| D. | 它和白磷都是磷的同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com