
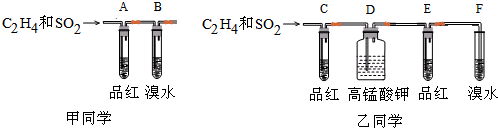
分析 (1)根据甲同学的实验装置可知,SO2和C2H4通过品红溶液,可以检验出SO2,但SO2不一定全被品红吸收,所以在试管B中溴水褪色的原因可以是C2H4,也可以是SO2;
(2)高锰酸钾能将乙烯氧化成二氧化碳;
(3)因为高锰酸钾能将乙烯氧化成二氧化碳,所以D装置中不能用高锰酸钾除二氧化硫,可以用氢氧化钠溶液除二氧化硫,根据二氧化硫能使品红褪色,乙烯能使溴水褪色答题;
(4)乙烯与溴水发生加成反应生成1,2-二溴乙烷.
解答 解:(1)根据甲同学的实验装置可知,SO2和C2H4通过品红溶液,可以检验出SO2,但SO2不一定全被品红吸收,所以在试管B中溴水褪色的原因可以是C2H4,也可以是SO2,所以甲同学的设计不科学,原因是未被品红吸收的SO2也可以是溴水褪色,干扰乙烯的检验,
故答案为:不科学,未被品红吸收的SO2也可以是溴水褪色,干扰乙烯的检验;
(2)高锰酸钾能将乙烯氧化成二氧化碳,所以装置D中应将把高锰酸钾换成NaOH溶液,
故答案为:把高锰酸钾换成NaOH溶液;
(3)因为高锰酸钾能将乙烯氧化成二氧化碳,所以D装置中不能用高锰酸钾除二氧化硫,可以用氢氧化钠溶液除二氧化硫,在改正后的实验中,能说明SO2存在的现象是 C中品红褪色,确定含有乙烯的现象是E中品红不褪色,F中溴水褪色,
故答案为:C中品红褪色;E中品红不褪色,F中溴水褪色;
(4)乙烯与溴水发生加成反应生成1,2-二溴乙烷,反应的化学反应方程式为CH2=CH2+Br2→CH2Br-CH2Br,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br.
点评 本题主要考查了实验室制乙烯产物的检验,当有多种产物需检验时,应考虑先后顺序,掌握二氧化硫、乙烯的性质是解题的关键,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应,只要是放热反应,理论上都能设计成原电池 | |
| B. | 周期表中所有元素都是从自然界中发现的 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 原子结合成分子过程中一定释放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥⑧ | B. | ②③⑤⑥⑦ | C. | ②③④⑥⑧ | D. | ①③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应时形成新化学键释放的能量大于断裂旧化学键所吸收的能量,则该化学反应是释放能量的反应 | |
| B. | 若反应物的总能量大于生成物的总能量,则该化学反应为释放能量的反应 | |
| C. | 化学反应中能量变化的大小与反应物的质量多少无关 | |
| D. | 化学反应必然伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 预期现象和结论 |
| 取少许吸收液于试管中滴加1~2滴0.01mol•L-1KMnO4溶液 | 若溶液褪色则假设1成立,否则假设1不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2倍 | B. | 1.5倍 | C. | 0.8倍 | D. | 0.5倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com