
为改善大气质量,国家拟于“十二五”期间,力争将CO2变为燃料或有机化学产品的构想变为现实,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.
Ⅰ.一种将CO2变为燃料或有机化学产品的构想分成3个步骤:
①利用浓碳酸钾溶液吸收空气中的CO2;
②将第①步吸收液电解产生H2和O2,同时分离出CO2;
③将第②步产生的H2(g)和CO2(g)在一定条件下转化成CH4(g)和H2O(l).
已知:H2(g)+![]() O2(g)=H2O(l) ΔH1=-285.8 kJ/mol
O2(g)=H2O(l) ΔH1=-285.8 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH2=-889.6 kJ/mol
写出第③步反应的热化学方程式为________.
Ⅱ.目前,消除大气污染有多种方法.
(1)处理NOx的一种方法是利用甲烷催化还原NOx.写出甲烷直接将NO2还原得到无污染的产物的化学方程式________.
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)该反应的化学平衡常数表达式为K=________.
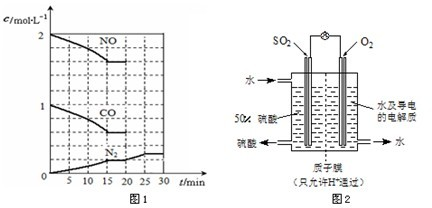
在一定温度下,将2 mol NO、1 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如下图所示.
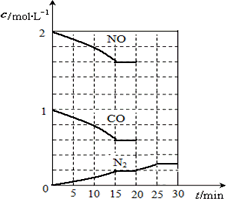
若保持温度不变,20 min时再向容器中充入CO、N2各0.6 mol,平衡将________移动(填“向左”、“向右”或“不”).
若20 min时改变反应条件,导致N2浓度发生如上图所示的变化,则改变的条件可能是________(填序号).
①加入催化剂
②降低温度
③缩小容器体积
④增加CO2的量
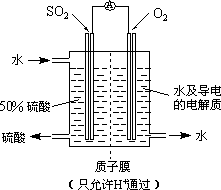
(3)最近,某科研单位研制成功一种处理SO2的方法:利用电化学原理将发电厂产生的大量SO2制成硫酸,装置如图,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06 V.实际过程中,将SO2通入电池的________极(填“正”或“负”),负极反应式为________.用这种方法处理SO2废气的优点是可回收大量有效能,副产品为H2SO4,减少环境污染.
科目:高中化学 来源: 题型:
| ||
| ||

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 2 |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
为改善大气质量,国家拟于“十二五”期间,力争将CO2变为燃料或有机化学产品的构想变为现实,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。
I.目前,消除大气污染有多种方法。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。写出甲烷直接将NO2还原得到无污染的产物的化学方程式 。
(2)降低汽车尾气的方法之一是在排气管上安装催化
转化器,发生如下反应:
2NO(g)+2CO(g)![]() N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。
该反应的化学平衡常数表达式为K= 。
在一定温度下,将2molNO、1molCO充入1L
 固定容积的容器中,反应过程中各物质的浓度变化
固定容积的容器中,反应过程中各物质的浓度变化
如下图所示。
若保持温度不变,20min时再向容器中充入
CO、N2各0.6mol,平衡将 移动(填“向左”、 “向右”或“不”)。
若20min时改变反应条件,导致N2浓度发生如右图所示的变化,则改变的条件可能
是 (填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
 (3)最近,某科研单位研制成功一种处理SO2的方法:利用电化学原理将发电厂产生的大量SO2制成硫酸,装置如右图,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,写出负极反应式为 。用这种方法处理SO2废气的优点是可回收大量有效能,副产品为H2SO4,减少环境污染。
(3)最近,某科研单位研制成功一种处理SO2的方法:利用电化学原理将发电厂产生的大量SO2制成硫酸,装置如右图,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,写出负极反应式为 。用这种方法处理SO2废气的优点是可回收大量有效能,副产品为H2SO4,减少环境污染。
II.有人提出用碳酸钠溶液吸收发电厂废气中的二氧化硫。
已知:H2SO3的电离平衡常数为 K1=1.54×10-2 ,K2=1.O2×10-7
H2CO3的电离平衡常数为K1=4.31×l0-7 K2=5.61×10-11
(4)请写出向碳酸钠溶液中通入一定量的SO2生成无污染的二氧化碳气体的的化学方程式
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省盐城中学高二(上)期中化学试卷(必修)(解析版) 题型:填空题
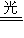 NO+O、②2NO+O2=2NO2、③O2+O=O3.则总反应可表示为 ,NO2在其中起了 作用.
NO+O、②2NO+O2=2NO2、③O2+O=O3.则总反应可表示为 ,NO2在其中起了 作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com