
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.-1648.8KJ/mol | B.-824.4KJ/mol | C.+1648.8KJ/mol | D.-744.7KJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.196.46 kJ | B.55.175 kJ |
| C.141.285 kJ | D.282.57 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)+H2O(g)△H1
CH3OH(g)+H2O(g)△H1 CH3OH(g) △H2
CH3OH(g) △H2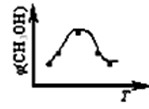
| A.升高温度 | B.增加CO2的量 |
| C.充入He,使体系总压强增大 | D.按原比例再充入CO2和H2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 则1 mol C与
则1 mol C与 反应生成CO的反应热
反应生成CO的反应热 H为
H为A.-(2.5x -0.5 y)  | B.-(5x - 0.5y)   |
C.-(10x - y)  | D.- y  |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 +1/2O2(g) ="=CO(g);" △H=-110.5 kJ/mol
+1/2O2(g) ="=CO(g);" △H=-110.5 kJ/mol 1/2O2(g)==H2O(g); △H=-241.8 kJ/mol
1/2O2(g)==H2O(g); △H=-241.8 kJ/mol O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol
O2(g)==16CO2(g)+18H2O(l); △H=-11036 kJ/mol 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com