
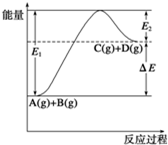
| A、1mol A与1mol B充分反应后,能量变化为△E |
| B、加入催化剂后,反应加快,△E减小 |
| C、反应物的总键能小于生成物的总键能 |
| D、反应达到平衡时,升高温度,A的转化率增大 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、在船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率 |
| B、粗铜精炼时,电解液中的c(Cu2+)保持不变 |
| C、Na+的焰色反应呈黄色,属于化学变化 |
| D、在滴定实验中,可以用碱式滴定管量取21.0mL的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 由于锌的性质与铝相似,也易溶于强碱溶液放出氢气,因此可采用碱溶气体法测定镀锌铁皮锌镀层的厚度,装置如图.下列关于该实验的判断不正确的是( )
由于锌的性质与铝相似,也易溶于强碱溶液放出氢气,因此可采用碱溶气体法测定镀锌铁皮锌镀层的厚度,装置如图.下列关于该实验的判断不正确的是( )| A、发生的反应是:Zn+2NaOH→Na2ZnO2+H2↑ |
| B、反应结束冷却后,要用针筒抽气直至储液瓶中导管内外液面相平 |
| C、若镀锌铁皮的锌镀层中混有金属铝杂质,则会导致测定结果偏小 |
| D、碱溶气体法测定铁皮锌镀层厚度容易判断反应终点,却不及酸溶重量法简便 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、标准状况下,密度为d g/L的某气体纯净物一个分子的质量为
| ||
| B、常温常压下,17g甲基(-14CH3)所含的中子数为9NA | ||
| C、将0.1NA个氯气分子溶于水配成1升溶液,溶液中c(Cl-)=0.1mol/L | ||
| D、铝与足量的NaOH反应,若每生成6.72L的H2,则溶液中AlO2-的数目就会增加0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、减小压强 |
| B、降低温度 |
| C、增大O2浓度 |
| D、使用合适的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期主族元素X、Y、Z、W 的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法正确的是( )
短周期主族元素X、Y、Z、W 的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等.下列说法正确的是( )| A、原子半径:r(Y)>r(Z)>r(W) |
| B、Y、Z、W的简单离子的电子层结构相同 |
| C、XWm与YWn中化学键类型相同(m、n为正整数) |
| D、元素Z的简单气态氢化物的热稳定性比W的简单气态氢化物强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铝溶液中加入过量氨水:Al3++3OH-═Al(OH)3↓ |
| B、向明矾溶液中滴加Ba(OH)2溶液至Al3+刚好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |
| C、NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O |
| D、稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
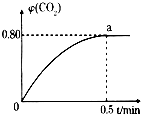 运用化学反应原理研究碳的化合物具有重要意义.
运用化学反应原理研究碳的化合物具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com