
【题目】CuH不稳定,易跟盐酸反应:2CuH+2HCl![]() CuCl2+2H2↑+Cu。下列说法正确的是
CuCl2+2H2↑+Cu。下列说法正确的是
A. CuH中H的化合价为+1 B. CuH在反应中只被还原
C. 在反应中HCl失去电子 D. Cu是反应的还原产物
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】100℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。下列叙述中不正确的是
A.此时水的离子积Kw=1×10-14B.水电离出的c(H+)=1×10-10molL-1
C.水的电离程度随温度升高而增大D.c(Na+)=c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:甲、乙、丙、丁为常见化合物,A、B为单质,相互转化关系如图。其中甲是天然气的主要成分。回答下列问题:
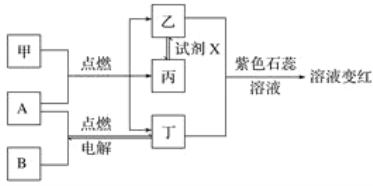
(1)丁物质的名称:______,丙物质的化学式:_________________________________________。
(2)检验化合物乙的化学方程式:___________________________________________________。
(3)试剂X可能的化学式:________、________(要求:所选物质类别不同)。
(4)通过分析表明:燃料充分燃烧的条件之一是______________________________。
(5)取变红溶液于试管中加热,观察到的现象有_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲利用如图所示的实验装置探究苯与液溴的反应(装置连接顺序为CDAB)
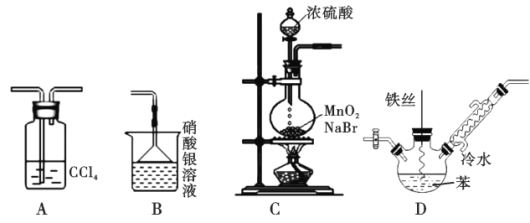
已知:MnO2+2NaBr+2H2SO4![]() Br2↑+MnSO4+Na2SO4+2H2O,下列说法不正确的是
Br2↑+MnSO4+Na2SO4+2H2O,下列说法不正确的是
A. 装置A的作用是除去HBr中的溴蒸气
B. 装置B的作用是检验HBr
C. 可以用装置C制取溴蒸气
D. 装置D反应后的混合液经稀碱溶液洗涤、结晶,得到溴苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙和X是四种中学化学中常见的物质,其转化关系如下图,则甲和X不可能是

A. 甲为C,X是O2
B. 甲为 Fe,X 为 Cl2
C. 甲为SO2,X是NaOH溶液
D. 甲为A1C13,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌及锌的化合物应用广泛。例如,测定铜合金中的铅、锌时要利用锌配离子的下列反应:[Zn(CN)4]2-+4HCHO+4H2O=Zn2++4HOCH2CN+4OH-
回答下列问题:
(1)基态Zn2+的电子排布式为_____________,基态 C原子核外电子占据_____个不同原子轨道。
(2)C、N、O三种元素的第一电离能由大到小的顺序为___________,HOCH2CN分子中含有的σ键与π键数目之比为_________。
(3)HCHO分子中碳原子轨道的杂化类型是________,福尔马林是HCHO的水溶液,HCHO极易与水互溶的主要原因是_________________________。
(4)[Zn(CN)4]2-中Zn2+与CN-之间的化学键称为_________,提供孤电子对的成键原子是________。
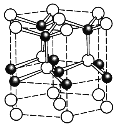
(5)ZnO的一种最稳定的晶体结构如图所示,晶胞中Zn2+的配位数为______。六棱柱底边长为acm,高为bcm,设阿伏加德罗常数的值为NA,则ZnO的密度为_______ g/cm3(列出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法正确的是( )
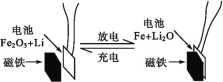
A.放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O
B.该电池可以用水溶液作电解质溶液
C.放电时,Fe作电池的负极,Fe2O3作电池的正极
D.充电完成后,电池被磁铁吸引
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
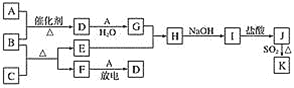
已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断正误![]() 正确的打“
正确的打“![]() ”,错误的打“
”,错误的打“![]() ”
”![]() 。
。
(1)阴、阳离子通过静电引力形成离子键____。
(2)离子化合物中一定含有金属元素____。
(3)由金属元素和非金属元素形成的化合物一定是离子化合物____。
(4)阴、阳离子间通过离子键一定能形成离子化合物____。
(5)![]() 属于离子化合物,其电子式为
属于离子化合物,其电子式为 ____。
____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com