
| A. | “碘遇淀粉变蓝色”,“碘”指碘元素 | |
| B. | 为了补碘,要多食用含高碘酸的食物 | |
| C. | 碘水中加入CCl4后,充分混合后静置分层.CCl4在下层,呈现紫红色.如果在太空实验室中混合这两种液体,CCl4就未必在下层 | |
| D. | 通过“取样→灼烧→溶解→过滤→萃取”可从海带中提取单质碘 |
分析 A.“碘遇淀粉变蓝色”,“碘”指碘单质;
B.高碘酸中碘为+5价,具有很强的氧化性;
C.碘不易溶于水,易溶于四氯化碳,且四氯化碳的不溶于水、密度比水大,在太空实验室中失重;
D.从海带中提取单质碘通过“取样→灼烧→溶解→过滤→氧化→萃取→蒸馏等操作.
解答 解:A.碘单质和淀粉形成络合物呈现蓝色,而碘的化合物不具备该性质,故A错误;
B.高碘酸具有强烈的氧化性和腐蚀性,不能食用,补碘,可多食海带等含碘的物质,故B错误;
C.碘不易溶于水,易溶于四氯化碳,且四氯化碳的不溶于水、密度比水大,则碘水中加入适量的CCl4振荡后,分层,且上层为无色,下层为紫红色,如果在太空实验室中混合这两种液体,因失重CCl4就未必在下层,故C正确;
D.从海带中提取单质碘通过“取样→灼烧将有机物转化为无机盐,→溶解将含碘的化合物转变在溶液中→过滤,将杂质滤去→氧化将碘离子氧化成碘单质→通过萃取将碘单质萃取出→通过蒸馏等到碘单质,故D错误;
故选C.
点评 本题主要考查了碘及其化合物的性质,掌握碘单质遇淀粉变蓝以及从海带中提取单质碘的原理是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 431kJ/mol | B. | 946 kJ/mol | C. | 649 kJ/mol | D. | 869 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
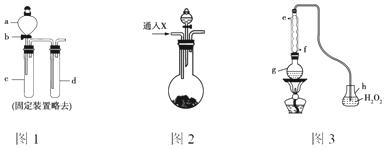
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸 纯碱 孔雀石 | B. | 硝酸 烧碱 明矾 | ||
| C. | 醋酸 乙醇 碳酸钙 | D. | 盐酸 熟石灰 苛性钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
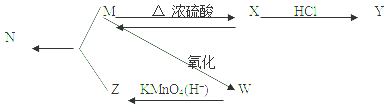
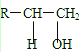 $→_{△}^{浓硫酸}$R-CH=CH2+H2O,叫做消去反应
$→_{△}^{浓硫酸}$R-CH=CH2+H2O,叫做消去反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | Cl- | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| ③ | KClO3 | 浓盐酸 | Cl2 |
| A. | 表中①组的反应可能有一种或两种元素被氧化 | |
| B. | 氧化性哟弱的比较:KClO3>Fe3+>Br2>Cl2 | |
| C. | 表中③组反应的还原产物是KCl,电子转移数目是6e | |
| D. | 表中②组反应的化学方程式为:2KMnO4+3H2O2+3H2SO4→2MnSO4+K2SO4+4O2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | FeCl2溶液中加入氯水:Cl2+Fe2+═Fe3++2Cl- | |
| C. | 碳酸氢钠与稀硫酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | NaOH溶液与小苏打溶液反应 HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com