
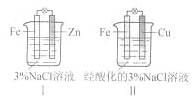
| A.Ⅰ是验证牺牲阳极的阴极保护法的实验装置 |
| B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| D.Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
科目:高中化学 来源:不详 题型:单选题
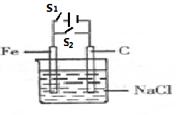
| A.断开S1,闭合S2,C电极上发生的反应为O2+4e-+4H+=2H2O |
| B.断开S1,闭合S2,Fe电极作原电池的负极,发生还原反应。 |
| C.闭合S1,断开S2,溶液中的Cl- 向C电极方向移动。 |
| D.闭合S1,断开S2,阳极本身失电子,被氧化。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C2H5OH在电池的负极上参加反应 |
| B.1mol乙醇被氧化转移6mol电子 |
| C.在外电路中电子由负极沿导线流向正极 |
| D.电解质溶液中阳离子移向正极,阴离子移向负极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.锌外壳是负极,石墨碳棒是正极材料 | B.在外电路中电子从碳棒流向锌外壳 |
| C.电流从锌流到碳棒上 | D.在电池内部阳离子从碳棒向锌片移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 。下列相关描述错误的是
。下列相关描述错误的是
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铅蓄电池在放电过程中,负极质量最终减小,正极质量最终增加 |
| B.放热反应不一定能自发进行 |
| C.一定条件下,使用催化剂能加快反应速率,但不能提高反应物的平衡转化率 |
| D.温度一定,当溶液中Ag+和Cl-浓渡的乘积等于Ksp时,溶液为AgCl的饱和溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
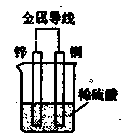
| A.电流从锌电极经金属导线流向铜电极 |
| B.锌为阴极,铜为阳极 |
| C.负极的电极反应式为:Zn—2e→Zn2+ |
| D.一段时间后,溶液中阳离子浓度增大、阴离子浓度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 溶液、Fe
溶液、Fe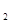 (SO
(SO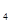 )
) 溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? (填“能”或“不能”)。若能,请写出电极反应式:负极 ,正极 。若不能,请说明原因 。
溶液、盐酸。按要求回答下列问题:若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? (填“能”或“不能”)。若能,请写出电极反应式:负极 ,正极 。若不能,请说明原因 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钢板中的铁做负极,电极反应为Fe — 2e- ="=" Fe2+ |
| B.放电时正极上有氧气生成 |
| C.放电时OH-向正极移动 |
| D.电池总反应为:2Li+2H2O="==" 2LiOH+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com