
| A. | 原子晶体中的各相邻原子都以共价键相结合 | |
| B. | 金属导电的原因是在外电场作用下金属产生自由电子,电子定向运动 | |
| C. | 分子晶体的熔沸点很低,常温下都呈液态或气态 | |
| D. | 离子晶体中每个离子周围均吸引着6个带相反电荷的离子 |
分析 A、原子晶体中原子间作用力为共价键;
B、金属导电的原因是有自由电子,金属里本来就存在有自由电子;
C、分子晶体存在常温下呈固态的物质;
D、离子所带电荷数和离子半径的大小不同,每个离子周围均吸引带相反电荷的离子数目不同.
解答 解:A、原子晶体中原子间作用力为共价键,故A正确;
B、金属里本来就存在有自由电子,在金属未通电的情况下,金属中的电子是在做热运动,即无规则运动,在外加电场的作用下自由电子做定向移动,而不是产生了自由电子,故B错误;
C、分子晶体存在常温下呈固态的物质,例如S、白磷、红磷、C60等都属于分子晶体,在常温下为固态,故C错误;
D、离子所带电荷数和离子半径的大小不同,每个离子周围均吸引带相反电荷的离子数目不同,一个NaCl晶胞为立方体,Na+离子在立方体中心的话,离它最近的Cl-离子在立方体六个面的中央,CsCl的晶胞也是立方体,Cs+离子在立方体中心的话,离它最近的Cl-离子就在立方体的八个顶点上,故D错误.
故选A.
点评 本题考查晶体的类型与性质,题目难度不大,注意晶体的组成、结构、性质等知识的积累.


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子晶体中共价键越强,熔点越高 | |
| B. | 晶体中分子间作用力越大,分子越稳定 | |
| C. | 冰融化时水分子中共价键发生断裂 | |
| D. | 氯化钠熔化时离子键未被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
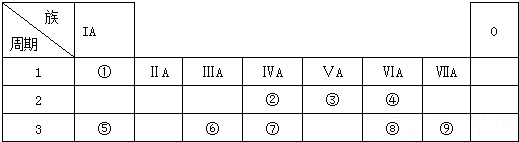
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X和Y都是非金属元素,其中X的最高化合价为+5价 | |
| B. | X与Y所能形成的化合物都是酸性氧化物 | |
| C. | 元素X的氧化物的水化物是强酸 | |
| D. | X的氢化物极易溶于水,可以用来做喷泉实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17.8 mL | B. | 14.8 mL | C. | 12.6 mL | D. | 12.4 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 上世纪60年代,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念.在随后的几年内,科学家又相继合成了氙的氟化物、氧化物等.
上世纪60年代,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对惰性”的观念.在随后的几年内,科学家又相继合成了氙的氟化物、氧化物等.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
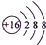
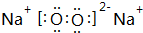 ,含有的化学键类型有离子键、共价键
,含有的化学键类型有离子键、共价键查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com