
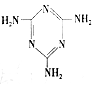
 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 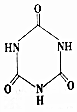 )
)分析 (1)根据等电子体的概念确定与CN22-互为等电子体的分子,根据二氧化碳的空间构型确定CN22-离子的空间构型;
(2)氢键普遍存在于已经与N、O、F等电负性很大的原子形成共价键的氢原子与另外的N、O、F等电负性很大的原子之间.
解答 解:(1)与CN22-互为等电子体的分子有N2O和CO2;等电子体具有相同的价电子数、原子总数,结构相似,二氧化碳分子是直线形,所以CN22-离子的空间构型是直线形.
故答案为:CO2;直线型;
(2)三聚氰酸与三聚氰胺分子相互之间能形成氢键,所以是通过分子间氢键结合,在肾脏内易形成结石,
故答案为:分子间氢键.
点评 本题综合考查等电子体知识,难度中等,注意等电子体的原理的熟练应用,为高频考点,题目难度不大.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醛和甲酸甲酯 | B. | 乙烷和乙醇 | C. | 苯和苯甲酸 | D. | 乙炔和苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl是还原产物 | |
| B. | NaClO只含有离子键 | |
| C. | 当释放(标况下)2.24L Cl2时,一定有6.02×1022个氯分子扩散到室内 | |
| D. | 使用消毒液时滴加食醋可加快作用发挥,其原因用离子方程式表示为 ClO-+CH3COOH═HClO+CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
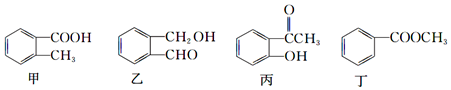
| A. | 甲:①②③④⑥⑦ | B. | 乙:①②③⑤⑥⑦ | C. | 丙:①②③④⑤⑥⑦ | D. | 丁:②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
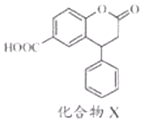
| A. | 分子中两个苯环一定处于同一平面 | |
| B. | 1mol化合物X最多可与8molH2发生加成反应 | |
| C. | 在酸性条件下水解,水解产物只有一种 | |
| D. | 1mol化合物X最多能与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ||||||
| ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
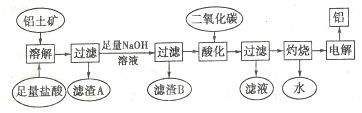
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
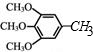 )是重要的医药中间体,利用甲苯为原料合成3,4,5-三甲氧基甲苯的路线如下:
)是重要的医药中间体,利用甲苯为原料合成3,4,5-三甲氧基甲苯的路线如下: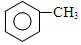 $\stackrel{Br_{2}}{→}$A$\stackrel{NaOH}{→}$
$\stackrel{Br_{2}}{→}$A$\stackrel{NaOH}{→}$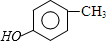 $→_{CH_{3}OH}^{Br_{2}}$B$→_{CH_{3}ONa}^{CuCl,DMF}$
$→_{CH_{3}OH}^{Br_{2}}$B$→_{CH_{3}ONa}^{CuCl,DMF}$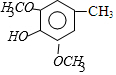 $\stackrel{NaOH}{→}$C$\stackrel{(CH_{3})_{2}SO_{4}}{→}$
$\stackrel{NaOH}{→}$C$\stackrel{(CH_{3})_{2}SO_{4}}{→}$
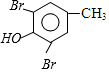 ,C的结构简式为
,C的结构简式为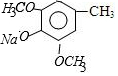 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com