
| ||
| ||


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
| A、Mg(NO3)2、NO2、O2 |
| B、MgO、NO2、O2 |
| C、Mg3N2、O2 |
| D、MgO、NO2、N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 )是一种重要的有机化工原料.
)是一种重要的有机化工原料. ,此烷烃的一溴代物有
,此烷烃的一溴代物有查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B、0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小 |
| C、CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D、常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁有剩余,溶液呈浅绿色,Cl-离子的浓度基本不变 |
| B、往溶液中滴加无色的KSCN溶液,溶液颜色不变 |
| C、Fe2+和Fe3+ 的物质的量之比为6:1 |
| D、氧化产物和还原产物的物质的量之比为2:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
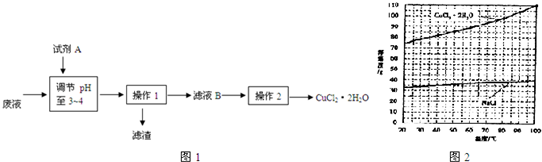
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、①②④⑤ |
| C、③④⑤ | D、①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCl2在熔融状态下可导电,它是强电解质 |
| B、自来水可用氯气来杀菌消毒,说明氯气无毒 |
| C、碱性氧化物一定是金属氧化物 |
| D、减少化石燃料的燃烧,是缓解大气“温室效应”的有效措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NaHCO3═Na2CO3+H2O+CO2↑ |
| B、KClO3+6HCl(浓)=KCl+3H2O+3Cl2↑ |
| C、CO2+Ca(OH) 2=CaCO3↓+H2O |
| D、FeS+H2SO4=FeSO4+H2S↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com