
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如图探究实验:
(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,若盐桥中装有饱和的KNO3溶液和琼胶制成的胶冻,则NO3﹣移向装置(填写“甲或乙”).其他条件不变,若将CuCl2溶液换为NH4Cl溶液,发现生成无色无味的单质气体,则石墨上电极反应式 . 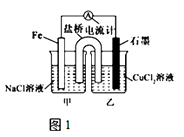
(2)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则甲装置是(填“原电池或电解池”),乙装置中石墨(2)为极,乙装置中与铁线相连的石墨(1)电极上发生的反应式为 . 
(3)在图2乙装置中改为加入CuSO4溶液,一段时间后,若某一电极质量增重 1.28g,则另一电极生成mL(标况下)气体.
【答案】
(1)甲;2H++2e﹣=H2↑
(2)原电池;阳;Cu2++2e﹣=Cu
(3)224
【解析】解:(1)如图1为原电池装置,铁为负极,阴离子硝酸根向负极移动,所以NO3﹣移向甲移动;正极是氢离子放电生成氢气,电极反应式为:2H++2e﹣=H2↑,所以答案是:甲; 2H++2e﹣=H2↑;(2)其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则甲装置是活泼金属发生自发的氧化还原反,是原电池;乙装置中石墨(2)与电池的正极相连是阳极,乙装置中与铁线相连的石墨(1)电极是阴极,发生还原反应,电极反应式为:Cu2++2e﹣=Cu,所以答案是:原电池; 阳; Cu2++2e﹣=Cu;(3)在图2乙装置中改为加入CuSO4溶液,一段时间后,若某一电极质量增重 1.28g,即生成铜 1.28g,物质的量为:0.02mol,所以另一极析出氧气的物质的量为:0.01mol,所以另一电极生成224mL(标况下)气体,所以答案是:224.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】实验室可用NaNO2+NH4Cl=NaCl+N2↑+2H2O制备N2,下列说法正确的是( )
A. NaNO2发生氧化反应
B. NH4Cl中的氮元素被还原
C. N2既是氧化产物,又是还原产物
D. 每生成1mol N2转移电子的物质的量为6mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在PH=14的溶液中,能大量共存的无色溶液是( )
A.Na+、Cu2+、Cl-、SO42-B.Mg2+、Ba2+、NO3-、Cl-
C.K+、Na+、SO42-、CO32-D.K+、Ag+、HCO3-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】车用妄全气囊中反应方程式为BNaN3=2Na+3N2↑,用双桥线标出电子 转移的数目和变化类型,指出氧化剂和还原剂.若要得到标准状况下33.6LN2 , 需要多少克NaN3(写出计算过程),NaN3的密度约为2g/cm3 , 则NaN3的体积约为多少立方厘米.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)CH3OH(g)△H=a kJmol﹣1 . 向体积为2L的密闭容器中充入2mol CO和4mol H2 , 测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示: 
(1)能判断反应达到化学平衡状态的是(填字母).
A.c(CO)与c(H2)的比值保持不变
B.容器中气体压强保持不变
C.容器中气体密度保持不变
D.单位时间内有1molCO消耗的同时有1mol CH3OH生成
E.v正(H2)=2v逆(CH3OH)
(2)①Ⅱ和Ⅰ相比,Ⅱ改变的反应条件是 .
②反应Ⅲ在9min时达到平衡,比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1T3(填“>”“<”“=”),此正反应是反应(填“放热或吸热”).
(3)①反应Ⅰ在6min时达到平衡,从反应开始到达到平衡时v (CH3OH)=mol/(Lmin).
②反应Ⅱ在2min时达到平衡,计算该温度下的平衡常数K= . 在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1mol CO和3mol CH3OH后,平衡将向(填“正反应、逆反应和不移动”),原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示.下列判断正确的是( ) 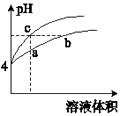
A.a、c两点溶液的导电能力相同
B.a、b、c三点溶液中水的电离程度:a>b>c
C.b点溶液中:c(H+)+c(NH3H2O)=c(OH﹣)
D.用NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K、L、M三个电子层.回答下列问题:
(1)A、B、C、D、E、F、G几种元素中第一电离能最小的是(填元素符号),D元素的原子核外有种不同运动状态的电子,有种不同能级的电子,基态的F3+核外电子排布式是 .
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是 .
(3)化合物AC2的电子式是 .
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 .
(5)化合物EF[F(AB)6]是一种蓝色晶体,如图1表示其晶胞的 ![]() (E+未画出).该蓝色晶体的一个晶胞中E+的个数为 .
(E+未画出).该蓝色晶体的一个晶胞中E+的个数为 . 
(6)G的二价阳离子能与乙二胺(H2N﹣CH2一CH2一NH2)形成配离子(如图2):该配离子中含有的化学键类型有 . (填字母) 
a.配位键 b.极性键 c.离子键 d.非极性键
阴离子CAB﹣中的A原子与乙二胺(H2N﹣CH2一CH2一NH2)中C原子的杂化方式分别为和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】隐形战机的核心材料是金属钛,我国探明储量世界第一.下列有关推断不正确的是( )
A.钛的原子序数为22
B.钛位于元素周期表第四周期
C.钛原子核外电子排布式为1s22s22p63s23p63d4
D.钛属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的数值.请回答下列问题:
(1)0.5mol SO2共含有约个原子,它与g SO3所含硫原子数相等.
(2)质量相同的①HCl、②NH3、③CO2、④O2四种气体中,在同温同压条件下,所占体积最小的是(填序号) .
(3)19g某二价金属氯化物(ACl2)中含有0.4mol Cl﹣ , 则ACl2的摩尔质量是;
(4)标准状况下某种O2和N2的混合气体m g,含有b个分子,则n g该混合气体在相同状况下所占的体积应是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com