
| A. | 向淀粉溶液中加入稀硫酸,加热一段时间后再加入银氨溶液,水浴加热,检验淀粉是否水解 | |
| B. | 向甲酸和甲醛的混合物中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热,检验混合物中是否含有甲醛 | |
| C. | 制硝基苯时,将盛有混合液的试管加热,控制温度100-110℃ | |
| D. | 要鉴别己烯中是否混有甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 |
分析 A.淀粉水解后显酸性,检验葡萄糖在碱性条件下;
B.中和甲酸后,生成的甲酸钠中含-CHO;
C.应水浴加热;
D.己烯与溴水发生加成反应.
解答 解:A.淀粉水解后显酸性,检验葡萄糖在碱性条件下,则水解后用NaOH中和,并做银镜反应实验才能检验淀粉是否水解,故A错误;
B.中和甲酸后,生成的甲酸钠中含-CHO,加入新制的氢氧化铜加热会生成砖红色沉淀,不能检验混合物中是否含有甲醛,故B错误;
C.因苯、硝酸易挥发,制硝基苯,应水浴加热,不能直接加热,故C错误;
D.先加足量溴水,己烯与溴水发生加成反应,排除双键的影响,然后再加入酸性高锰酸钾溶液,褪色可说明己烯中混有少量甲苯,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及淀粉水解实验、醛的性质及有机反应的条件,物质的鉴别等,把握实验原理及物质的性质为解答的关键,注意方案的操作性、评价性分析,题目难度中等.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制取蒸馏水时,冷却水应从冷凝管的上端进入 | |
| B. | 分液时,应把下层液体从下端放出后,再把上层液体从下端放出 | |
| C. | 过滤时,漏斗的下端应紧贴烧杯内壁 | |
| D. | 萃取时,所选的萃取剂的密度应比原溶液的密度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原剂的物质的量之比为1:14 | |
| B. | Cl2是该反应的氧化产物 | |
| C. | 当转移0.2mol电子时,被氧化的还原剂的物质的量为0.2mol | |
| D. | 由此反应可知还原性HCl>CrCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
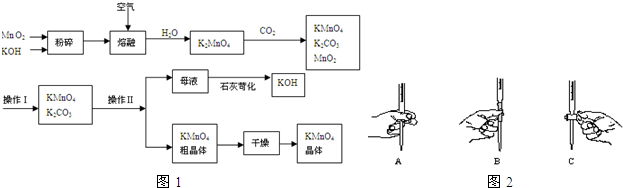
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 )
)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:5 | B. | 5:3 | C. | 5:6 | D. | 6:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳浊液 | B. | 溶液 | C. | 胶体 | D. | 悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动了 | B. | 物质A的转化率增加了 | ||
| C. | 物质B的质量分数减少了 | D. | b>a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com