
| 实验编号 | 盐酸的浓度/mol?L-1 | 滴定完成时,盐 酸滴入的体积/mL | 待测NaOH溶液 的体积/mL |
| 1 | 0.1152 | 26.72 | 25.00 |
| 2 | 0.1152 | 29.02 | 25.00 |
| 3 | 0.1152 | 26.70 | 25.00 |
| n |
| V |
| 26.72ml+26.71ml |
| 2 |
| 26.72ml+26.71ml |
| 2 |
| 26.72ml+26.71ml |
| 2 |
| 500ml |
| 25ml |
| 26.72ml+26.71ml |
| 2 |
| 500ml |
| 25ml |
| ||||
| 3.2g |
| ||||
| 3.2g |


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
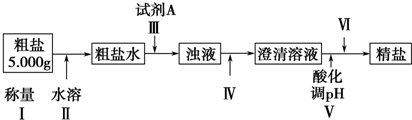
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
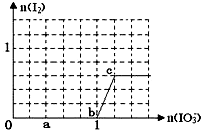 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,试回答下列问题:
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | L | M | Q | R | T | |
| 原子半径(10-10 m) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | |
| 常见化合价 | 最高正价 | +2 | +3 | +6 | +2 | |
| 最低负价 | -2 | -2 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 5 |
| 2 |
| A、当10NA个电子转移时,该反应放出1300kJ的能量 |
| B、当1NA个水分子生成且为液体时,吸收1300kJ的能量 |
| C、当2NA个碳氧共用电子对生成时,放出1300kJ的能量 |
| D、当6NA个碳氧共用电子对生成时,放出1300kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合物中n(Fe):n(Fe2O3)=2:1 |
| B、向溶液中滴入无色的KSCN溶液,显血红色 |
| C、无法计算出原混合物的质量 |
| D、此时溶液中Fe2+和Fe3+的物质的量之比为3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )| A、图中AB段的氧化剂为K2Cr2O7 |
| B、图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 |
| C、开始加入的K2Cr2O7为0.25 mol |
| D、K2Cr2O7可与FeSO4反应的物质的量为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、B>A>D>C |
| B、A>B>D>C |
| C、B>A>C>D |
| D、C>D>A>B |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com