
【题目】金属铜的冶炼方法较早的为人类掌握,人们用铜合金制造各种青铜器,古代的青铜器表面会有铜锈(碱式碳酸铜)生成,其成分可表示为:xCuCO3·yCu(OH)2·zH2O,实验室测定碱式碳酸铜成分的方法有多种。
(1)氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式_________________;
②实验装置用下列仪器连接而成:
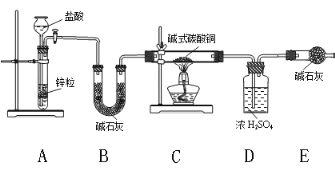
ⅰ、B装置的作用_________,装置中的一个明显缺陷,改进方法是_________________。
ⅱ、称取24 g某碱式碳酸铜样品进行试验,经数据分析处理,反应得到12.8g残留物,4.4g二氧化碳和7.2 g水。该样品中的结晶水质量为__________g,化学式为______________;
(2)某同学认为氢气还原法装置太复杂,提出简化的方法,认为可以只用C、D、E和改进后的装置直接加热碱式碳酸铜分解,你认为是否可行?请说明理由____________________。
【答案】xCuCO3·yCu(OH)2·zH2O+(x+y)H2![]() (x+y)Cu+xCO2↑+(x+2y+z)H2O除去氢气中的杂质HCl(g)和H2O(g)E后面加一个碱石灰的干燥管1.8CuCO3·Cu(OH) 2·H2O不可行,分解生成的气体不能完全被D、E装置吸收
(x+y)Cu+xCO2↑+(x+2y+z)H2O除去氢气中的杂质HCl(g)和H2O(g)E后面加一个碱石灰的干燥管1.8CuCO3·Cu(OH) 2·H2O不可行,分解生成的气体不能完全被D、E装置吸收
【解析】
(1)H2还原碱式碳酸铜生成Cu、CO2和H2O。装置A中Zn与反应盐酸制取H2;H2中混有HCl(g)和H2O(g),装置B中的碱石灰用于除去H2中的HCl(g)和H2O(g);装置C中H2还原碱式碳酸铜;装置D中浓硫酸吸收反应生成的H2O;装置E中碱石灰吸收反应生成的CO2;该装置的缺陷是:外界空气可以进入E中,使测得的CO2的质量偏高。由CO2的质量和C守恒计算n(CuCO3),由残留物的质量和Cu守恒计算n[Cu(OH)2],结合晶体的质量计算结晶水的质量和物质的量,计算化学式。
(2)直接加热碱式碳酸铜使其分解的方法不可行,分解生成的H2O(g)、CO2不能完全被D、E装置吸收。
(1)①H2还原碱式碳酸铜生成Cu、CO2和H2O,xCuCO3·yCu(OH)2·zH2O与H2反应的化学方程式为(x+y)H2+xCuCO3·yCu(OH)2·zH2O![]() (x+y)Cu+xCO2↑+(x+2y+z)H2O。答案为:(x+y)H2+xCuCO3·yCu(OH)2·zH2O
(x+y)Cu+xCO2↑+(x+2y+z)H2O。答案为:(x+y)H2+xCuCO3·yCu(OH)2·zH2O![]() (x+y)Cu+xCO2↑+(x+2y+z)H2O
(x+y)Cu+xCO2↑+(x+2y+z)H2O
②i.装置A中Zn与反应盐酸制取H2;H2中混有HCl(g)和H2O(g),装置B中的碱石灰用于除去H2中的HCl(g)和H2O(g)。装置C中H2还原碱式碳酸铜;装置D中浓硫酸吸收反应生成的H2O;装置E中碱石灰吸收反应生成的CO2;该装置的缺陷是:外界空气可以进入E中,E中碱石灰吸收空气中CO2和H2O(g),使测得的CO2的质量偏高,改进方法是:E后面加一个盛碱石灰的干燥管。答案为:除去H2中的HCl(g)和H2O(g) E后面加一个盛碱石灰的干燥管
ii.n(Cu)=![]() =0.2mol,反应生成的n(CO2)=
=0.2mol,反应生成的n(CO2)=![]() =0.1mol,根据C守恒,原样品中n(CuCO3)=n(CO2)=0.1mol,根据Cu守恒,原样品中n[Cu(OH)2]=0.2mol-0.1mol=0.1mol,该样品中结晶水的质量为24g-0.1mol×124g/mol-0.1mol×98g/mol=1.8g。结晶水物质的量为
=0.1mol,根据C守恒,原样品中n(CuCO3)=n(CO2)=0.1mol,根据Cu守恒,原样品中n[Cu(OH)2]=0.2mol-0.1mol=0.1mol,该样品中结晶水的质量为24g-0.1mol×124g/mol-0.1mol×98g/mol=1.8g。结晶水物质的量为![]() =0.1mol,x:y:z=0.1mol:0.1mol:0.1mol=1:1:1,化学式为CuCO3·Cu(OH)2·H2O。答案为:1.8 CuCO3·Cu(OH)2·H2O
=0.1mol,x:y:z=0.1mol:0.1mol:0.1mol=1:1:1,化学式为CuCO3·Cu(OH)2·H2O。答案为:1.8 CuCO3·Cu(OH)2·H2O
(2)直接加热碱式碳酸铜使其分解的方法不可行,因为分解生成的H2O(g)、CO2有部分残留在装置中,不能完全被D、E装置吸收。答案为:不可行,分解生成的H2O(g)、CO2不能完全被D、E装置吸收


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。
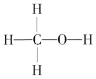
(1)燃煤废气中的CO2能转化为基础化工原料、清洁能源甲醇(CH3OH,甲醇的结构式如图):
3H2(g)+CO2(g) ![]() CH3OH (g) + H2O(g) △H
CH3OH (g) + H2O(g) △H
①已知:
化学键 | C-H | C-O | C=O | H-H | O-H |
键能/KJ/mol | 412 | 351 | 745 | 436 | 462 |
则△H = _________________
(2)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①到达平衡时NO的转化率为_________。
②用O2表示从0~2 s内该反应的平均速率v=____________________。
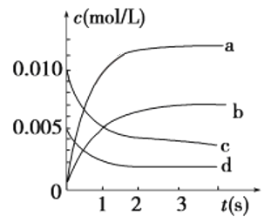
③如下图所示,表示NO2变化曲线的是________。
④能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内的密度保持不变
(3)某反应恒容密闭容器中进行, 在0~3分钟内各物质的量的变化情况如下图所示
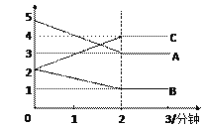
该反应的的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、X、W、D、E为短周期元素,且原子序数依次增大。A、D同主族,X、W同周期, X形成的气态氢化物可使湿润的红色石蕊试纸变蓝, A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)W的原子结构示意图为________。
(2)A、W两种元素能形成含18电子的分子,请写出该分子的电子式:_______________。用电子式表示化合物D2W的形成过程______________________。
(3)下列事实能说明W元素的非金属性比S元素的非金属性强的是________ (填字母)。
a.W单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol W单质比1 mol S得电子多
c.W和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X的最高价氧化物对应水化物与其简单气态氢化物所形成的化合物中含有的化学键类型是_______
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 等量的氯气分别与足量氢氧化钠和硫化钠充分反应,转移的电子数相同
B. 等量的铜分别与足量浓、稀硝酸充分反应,生成气体的物质的量相同
C. 等量的铝分别与氢氧化钠溶液和盐酸充分反应,生成气体体积一定相同
D. 等量的铁分别与足量氯气和硫充分反应,生成物质的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬元素及其化合物在生产、生活中具有广泛的用途。以某铬矿石(主要成分是Cr2O3,含Fe2O3、SiO2等杂质)为原料生产Cr2O3的流程如下:
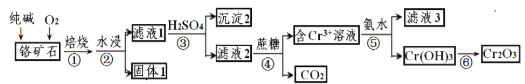
已知:2Cr2O3+4Na2CO3+3O2![]() 4Na2CrO4+4CO2,焙烧时SiO2也参与反应。
4Na2CrO4+4CO2,焙烧时SiO2也参与反应。
(1)Cr(OH)3和Al(OH)3性质类似,则Cr(OH)3与KOH反应的离子方程式为_________________;
(2)沉淀2的化学式为__________;
(3)步骤③中CrO42-转化成Cr2O72- ,写出其离子方程式____________________,硫酸能否换成盐酸并说明其理由___________________;
(4)滤液3中的主要溶质是两种盐,其化学式为__________________________;
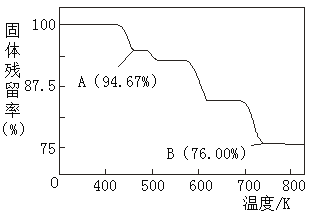
(5)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示,则B点时铬的氧化物化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
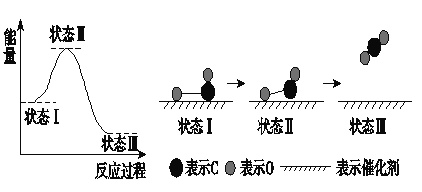
下列说法中正确的是( )
A. CO和O生成了具有共价键的CO2 B. 在该过程中,CO断键形成C和O
C. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程 D. CO和O生成CO2是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
与足量的10mol/L硫酸液混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
A. 反应中硫酸作氧化剂
B. ![]() 中硫元素被氧化
中硫元素被氧化
C. 刺激性气味的气体是氨气
D. 1mol![]() 完全反应转移0.5mol电子
完全反应转移0.5mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列与化学相关的说法正确的是 ( )
A.水泥、陶瓷、水晶均属于硅酸盐产品
B.医用酒精和Fe(OH)3胶体可用丁达尔效应区分
C.氯水和食盐水消毒杀菌的原理相同
D.盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.2 mol·L-1NaOH溶液480 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是________(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。

(2)下列有关容量瓶使用方法的操作中,错误的是_______。
A.使用容量瓶之前应检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复上下颠倒,摇匀
(3)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度________(填“>”“<”或“=”)0.2 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“>”“<”或“=”)0.2 mol·L-1。
(4)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________(计算结果保留一位小数)mL;
②如果实验室有15 mL、20 mL、50 mL量筒,应选用______mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是___________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com