
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 单质与同浓度稀盐酸反应的速率为L<M | |
| B. | R与T形成的化合物一定能使品红溶液褪色 | |
| C. | 氢化物的稳定性为:H2T>H2R | |
| D. | 当单质L着火时,可用CO2灭火 |
分析 短周期元素中,R、T都有-2价,位于ⅥA族,其中R有+6价,且原子半径较大,则T为O元素,R为S元素;L、Q都有+2价,处于ⅡA族,且L的原子半径较大,则L为Mg,Q为Be;M的最高正价为+3价,处于ⅢA族,原子半径大于S,则M为Al,结合元素对应单质化合物的性质以及元素周期律知识解答.
解答 解:短周期元素中,R、T都有-2价,位于ⅥA族,其中R有+6价,且原子半径较大,则T为O元素,R为S元素;L、Q都有+2价,处于ⅡA族,且L的原子半径较大,则L为Mg,Q为Be;M的最高正价为+3价,处于ⅢA族,原子半径大于S,则M为Al.
A.金属性Mg>Al,故Mg与盐酸反应更剧烈,故A错误;
B.R与T形成的化合物有 SO2、SO3,SO3不能使品红溶液褪色,故B错误;
C.非金属性T(O)>R(S),则气态氢化物的稳定性H2T>H2R,故C正确;
D.Mg可以在CO2中燃烧生成MgO与碳,故D错误.
故选:C.
点评 本题考查性质结构位置关系应用,难度中等,根据元素化合价与半径确定元素是解题关键,熟练掌握元素周期律知识,注意基础知识的全面掌握.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
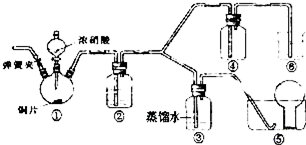
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+) | |
| B. | 1 mol•L-1的硫化钠溶液中,c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-) | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 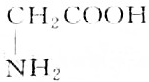 | B. | 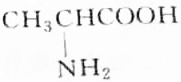 | ||
| C. | 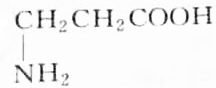 | D. | 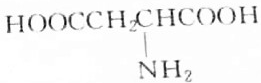 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍、镁、钙、锶、钡等碱土金属元素,在自然界都以化合态存在 | |
| B. | 从元素周期表知道,现在已经发现了113种原子 | |
| C. | 室温时,0族元素的单质都是气体 | |
| D. | 第三周期的主族元素原子的最高正价数与原子最外层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
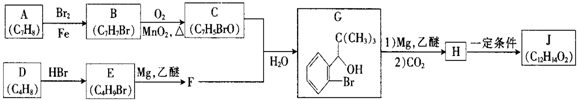
 (写明反应条件).
(写明反应条件).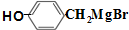 与CO2反应生成X,X的同分异构体中:
与CO2反应生成X,X的同分异构体中: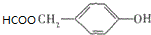 .
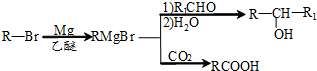
.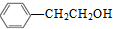 )的路线流程图(其它试剂任选).合成路线流程图表达方法例如下:
)的路线流程图(其它试剂任选).合成路线流程图表达方法例如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com