
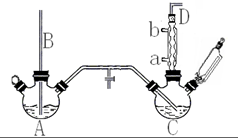
 Āȱ½ŹĒÖŲŅŖµÄÓŠ»ś»Æ¹¤²śĘ·£¬ŹĒČ¾ĮĻ”¢Ņ½Ņ©”¢ÓŠ»śŗĻ³ÉµÄÖŠ¼äĢ壬¹¤ŅµÉĻ³£ÓĆ”°¼äŠŖ·Ø”±ÖĘČ”£®·“Ó¦ŌĄķ”¢ŹµŃé×°ÖĆĶ¼£Ø¼ÓČČ×°Öƶ¼ŅŃĀŌČ„£©ČēĻĀ£ŗ
Āȱ½ŹĒÖŲŅŖµÄÓŠ»ś»Æ¹¤²śĘ·£¬ŹĒČ¾ĮĻ”¢Ņ½Ņ©”¢ÓŠ»śŗĻ³ÉµÄÖŠ¼äĢ壬¹¤ŅµÉĻ³£ÓĆ”°¼äŠŖ·Ø”±ÖĘČ”£®·“Ó¦ŌĄķ”¢ŹµŃé×°ÖĆĶ¼£Ø¼ÓČČ×°Öƶ¼ŅŃĀŌČ„£©ČēĻĀ£ŗ
| ĻīÄæ | ¶žĀȱ½ | Ī²Ęų | ²»Č·¶Ø±½ŗÄ | Į÷Ź§×ÜĮæ |
| ±½Į÷Ź§Įæ£Økg/t£© | 13 | 24.9 | 51.3 | 89.2 |
·ÖĪö £Ø1£©²£Į§¹ÜBÉģČėŅŗĆęĻĀ£¬×°ÖĆÄŚŃ¹Ēæ¹ż“óŹ±£¬æÉŅŌÓĆÓŚĘ½ŗāĘųŃ¹£»²ÉČ”ÄęĮ÷ŌĄķĶØČėĄäÄżĖ®£»
£Ø2£©¢Ł·“Ó¦Ę÷C¼ÓČČæŲÖĘ·“Ó¦ĪĀ¶ČŌŚ40-60”ę£¬Ó¦ĄūÓĆĖ®Ō”¼ÓČČ£»
¢ŚÓÉÓŚ±½Ņ×»Ó·¢£¬·“Ó¦²śÉśµÄHCl£¬ĒŅÓŠĪ“·“Ó¦µÄĀČĘų£¬¶¼»įŌŚD³öæŚµ¼³ö£»
£Ø3£©“߻ƼĮĀČ»ÆĢśÓėĒāŃõ»ÆÄĘ·“Ó¦£¬Éś³ÉµÄHCl»įÓėĒāŃõ»ÆÄĘ·“Ó¦£¬ČܽāµÄĀČĘųŅ²»įÓėČ„Ńõ»ÆÄĘ·“Ó¦£»
£Ø4£©A”¢C·“Ó¦Ę÷Ö®¼äŠčŅŖŌöĢķøÉŌļ×°ÖĆ£¬øÉŌļÉś³ÉµÄĀČĘų£¬æÉŅŌÓĆĪåŃõ»Æ¶žĮ×»ņĀČ»ÆøĘµČ£»
£Ø5£©øł¾Ż±½µÄ×ÜĮ÷Ź§Įæ¼ĘĖć²Ī¼Ó·“Ó¦µÄ±½µÄÖŹĮ棬ŌŁøł¾Ż±½ÓėĀȱ½ÖŹĮæ¶Ø±Č¹ŲĻµ¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©²£Į§¹ÜBÉģČėŅŗĆęĻĀ£¬×°ÖĆÄŚŃ¹Ēæ¹ż“óŹ±£¬æÉŅŌÓĆÓŚĘ½ŗāĘųŃ¹£»²ÉČ”ÄęĮ÷ŌĄķĶØČėĄäÄżĖ®£¬Ź¹ĄäÄż¹Ü³äĀśĄäÄżĖ®£¬³ä·ÖĄäČ“£¬¼“ĄäÄżĖ®ÓÉaæŚĮ÷Čė£¬ÓÉbæŚĮ÷³ö£¬
¹Ź“š°øĪŖ£ŗĘ½ŗāĘųŃ¹£»a£»
£Ø2£©¢Ł·“Ó¦Ę÷C¼ÓČČæŲÖĘ·“Ó¦ĪĀ¶ČŌŚ40-60”ę£¬Ó¦ĄūÓĆĖ®Ō”¼ÓČČ£¬¹ŹŃ”£ŗc£»
¢ŚÓÉÓŚ±½Ņ×»Ó·¢£¬·“Ó¦²śÉśµÄHCl£¬ĒŅÓŠĪ“·“Ó¦µÄĀČĘų£¬D³öæŚĘųĢåÖŠŗ¬ÓŠHCl”¢±½ÕōĘū”¢ĀČĘų£¬
¹Ź“š°øĪŖ£ŗ±½ÕōĘū”¢ĀČĘų£»
£Ø3£©¢Ś“߻ƼĮĀČ»ÆĢśÓėĒāŃõ»ÆÄĘ·“Ó¦£¬Éś³ÉHCl»įÓėĒāŃõ»ÆÄĘ·“Ó¦£¬ČܽāµÄĀČĘųŅ²»įÓėČ„Ńõ»ÆÄĘ·“Ó¦£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗFeCl3+3NaOH=Fe£ØOH£©3”ż+3NaCl”¢HCl+NaOH=NaCl+H2O”¢Cl2+2NaOH=NaCl+NaClO+H2O£¬
¹Ź“š°øĪŖ£ŗFeCl3+3NaOH=Fe£ØOH£©3”ż+3NaCl”¢HCl+NaOH=NaCl+H2OµČ£»
£Ø4£©A”¢C·“Ó¦Ę÷Ö®¼äŠčŅŖŌöĢķUŠĶ¹Ü£¬øÉŌļÉś³ÉµÄĀČĘų£¬æÉŅŌÓĆĪåŃõ»Æ¶žĮ×»ņĀČ»ÆøĘµČ£¬
¹Ź“š°øĪŖ£ŗĪåŃõ»Æ¶žĮ×»ņĀČ»ÆøĘ£»
£Ø5£©±½µÄ×ÜĮ÷Ź§ĮæĪŖ89.2kg/t£¬¹Ź1t±½ÖŠ²Ī¼Ó·“Ó¦µÄ±½µÄÖŹĮæĪŖ£Ø1t-0.0892t£©£¬Óɱ½ÓėĀȱ½ÖŹĮæÖ®±ČĪŖ78£ŗ112.5£¬æÉÖŖÉś³ÉĀȱ½ÖŹĮæĪŖ$\frac{£Ø1-0.0892£©”Į112.5}{78}$t£¬
¹Ź“š°øĪŖ£ŗ$\frac{£Ø1-0.0892£©”Į112.5}{78}$£®
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļÖʱøŹµŃé·½°ø£¬Éę¼°¶Ō×°ÖĆ”¢²Ł×÷ÓėŌĄķµÄ·ÖĪöĘĄ¼ŪŅŌ¼°»Æѧ¼ĘĖćµČ£¬ŹĒ¶Ōѧɜ×ŪŗĻÄÜĮ¦µÄ漲飬ÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | ĢśøśĻ”ĮņĖį·“Ó¦£ŗ2Fe+6H+”ś2Fe3++3H2”ü | |
| B£® | ĻņĀČ»ÆŃĒĢśČÜŅŗÖŠĶØČėĀČĘų£ŗFe2++Cl2”śFe3++2Cl- | |
| C£® | ŃĪĖįµĪČėĒāŃõ»Æ±µČÜŅŗÖŠ£ŗH++OH-=H2O | |
| D£® | ĀČĘųĶØČėNaOHČÜŅŗÖŠ£ŗCl2+2OH-=Cl-+ClO-+H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
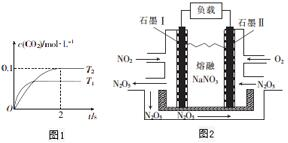 Ęū³µĪ²ĘųŗĶČ¼ĆŗĪ²ĘųŹĒŌģ³ÉæÕĘųĪŪČ¾µÄŌŅņÖ®Ņ»£®
Ęū³µĪ²ĘųŗĶČ¼ĆŗĪ²ĘųŹĒŌģ³ÉæÕĘųĪŪČ¾µÄŌŅņÖ®Ņ»£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ¢ŚŅŅĻ©¢ŪSO2 ¢ÜĀČŅŅĻ©
¢ŚŅŅĻ©¢ŪSO2 ¢ÜĀČŅŅĻ©| A£® | ¢Ł¢Ž¢ß | B£® | ¢Ł¢Ū¢Ü¢Ž | C£® | ¢Ł¢Ü¢ß | D£® | ¢Ł¢Ū¢Ž¢ß |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
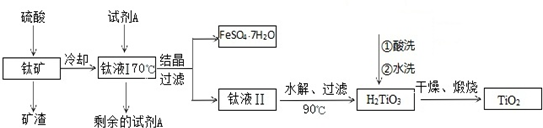
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
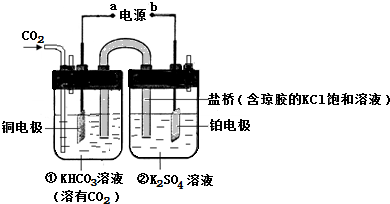
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | pH=0µÄČÜŅŗ£ŗK+”¢Ca2+”¢HCO3-”¢NO3- | |
| B£® | “ęŌŚ½Ļ¶ąµÄNa+”¢SO42-”¢OH-”¢µÄČÜŅŗÖŠ£ŗMg2+”¢Ba2+”¢Br- | |
| C£® | Ź¹×ĻÉ«ŹÆČļ±äĄ¶µÄČÜŅŗ£ŗK+”¢Na+”¢CH3COO-”¢SO42- | |
| D£® | ÓÉĖ®µēĄė³öµÄc£ØH+£©ĪŖ1”Į10-10 mol/LČÜŅŗÖŠ£ŗK+”¢Fe2+”¢SO42-”¢NO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ķ¬·ÖŅģ¹¹Ģå | B£® | Ķ¬ĖŲŅģŠĪĢå | C£® | Ķ¬Ī»ĖŲ | D£® | Ķ¬ĻµĪļ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com