
【题目】依照阿伏伽德罗定律,下列叙述正确的是 ( )
A. 同温同压下两种气体的体积之比等于摩尔质量之比
B. 同温同压下两种气体的物质的量之比等于密度之比
C. 同温同压下两种气体的摩尔质量之比等于密度之比
D. 同温同体积下两种气体的物质的量之比等于压强的反比
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)某芳香烃结构为![]() 。它的分子式为________,一氯代物有________种。
。它的分子式为________,一氯代物有________种。
(2)分子式为C6H12的某烃的所有碳原子都在同一平面上,则该烃的结构简式为__________________________,
若分子式为C4H6的某烃中所有的碳原子都在同一条直线上,则该烃的结构简式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol·L-1
mol·L-1
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知充分燃烧a g乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是( )
A.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣2b kJ?mol﹣1
B.C2H2(g)+ ![]() O2(g)═2CO2(g)+H2O(l)△H=+2b kJ?mol﹣1
O2(g)═2CO2(g)+H2O(l)△H=+2b kJ?mol﹣1
C.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=﹣4b kJ?mol﹣1
D.2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+b kJ?mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在200mLNa2CO3与NaAlO2的混合溶液中逐滴加入1molL﹣1的盐酸,测得溶液中的CO32﹣、HCO3﹣、AlO2﹣、Al3+离子的物质的量与加入盐酸溶液的体积变化关系,见下图一所示. 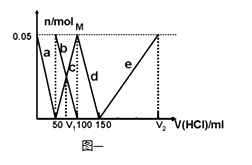
(1)原混合溶液中Na2CO3的物质的量浓度为molL﹣1
(2)V1:V2= .
(3)若滴加盐酸过程中得到沉淀0.975g,则滴入盐酸的体积可能为mL.
(4)在图二坐标中画出该混合溶液中逐滴加入1molL﹣1的盐酸,所得沉淀的物质的量与加入盐酸溶液的体积变化关系. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.化学试剂一经从存储容器中取出,剩余部分均不得再放回原容器,以免污染试剂
B.萃取振荡时要及时打开分液漏斗上口玻璃塞放气
C.检验干燥的气体时,试纸要湿润
D.金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在25 ℃的水溶液中,AgX、AgY、AgZ均难溶于水,但存在溶解平衡。当达到平衡时,溶液中离子浓度的乘积是一个常数(此常数用Ksp表示,Ksp和水的KW相似)。
如:AgX(s)![]() Ag+(aq)+X-(aq) Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
Ag+(aq)+X-(aq) Ksp(AgX)=c(Ag+)·c(X-)=1.8×10-10
AgY(s)![]() Ag+(aq)+Y-(aq) Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
Ag+(aq)+Y-(aq) Ksp(AgY)=c(Ag+)·c(Y-)=1.0×10-12
AgZ(s)![]() Ag+(aq)+Z-(aq) Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
Ag+(aq)+Z-(aq) Ksp(AgZ)=c(Ag+)·c(Z-)=8.7×10-17
(1)根据以上信息,判断AgX、AgY、AgZ三者的溶解度(用已被溶解的溶质的物质的量的浓度表示)S(AgX)、S(AgY)、S(AgZ)的大小顺序为____________________________。
(2)若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)________(填“增大“减小”或“不变”)。
(3)在25 ℃时,若取0.188 g的AgY(相对分子质量为188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y-的物质的量浓度为________。
(4)①由上述Ksp判断,在上述(3)的体系中,能否实现AgY向AgZ的转化,并简述理由:________________。
②在上述(3)体系中,能否实现AgY向AgX的转化?根据你的观点选答一项。
若不能,请简述理由:____________________________________。
若能,则实现转化的必要条件是:__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A. AgCl>AgI>Ag2CrO4 B. AgCl>Ag2CrO4>AgI
C. Ag2CrO4>AgCl>AgI D. Ag2CrO4>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答以下问题:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 .
(2)另称取已去除表面氧化物的铁钉(碳素钢)6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y. ①甲同学认为X中除Fe3+外还可能含有Fe2+ . 写出生成Fe2+所有可能的离子方程式: .
②乙同学取336ml(标准状况)气体Y通入足量氯水中,发生反应的化学方程式为: .
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为 .
(3)向100ml水中投入Na和Al共16克,充分反应后剩余金属1g.计算放出H2的体积为升(标准状况下)
(4)向含有0.3mol NaAlO2的溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为mL
(5)向一定量的Fe、Fe2O3和CuO混合物投入120ml 2.2mol/L的硫酸溶液中,充分反应后生成896mL标准状况下的气体,得不溶物1.28g,过滤后,向滤液中加入2mol/L的NaOH溶液,加至40mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为120ml)mol/L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com