
| c(Ca2+) |
| c(Mn2+) |
| ||
| ||
| c(Ca2+) |
| c(Mn2+) |
| Ksp(CaCO3) |
| Ksp(MgCO3) |
| 5×10-9 |
| 1×10-11 |
| c(Ca2+) |
| c(Mn2+) |


科目:高中化学 来源: 题型:
| A、与NaOH反应的氯气一定为0.3 mol |
| B、若反应中转移的电子为n mol,则0.15<n<0.25 |
| C、n(Na+):n(Cl-)可能为7:3 |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为8:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaCl2溶液 |
| B、稀盐酸 |
| C、KOH溶液 |
| D、NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L (NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| B、pH=4的醋酸稀释l0倍,溶液中c(CH3COOH)、c(OH-)均减小 |
| C、常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)=c(CH3COO-) |
| D、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
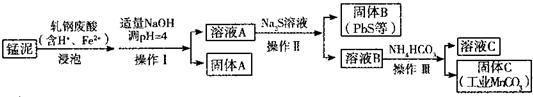
查看答案和解析>>
科目:高中化学 来源: 题型:
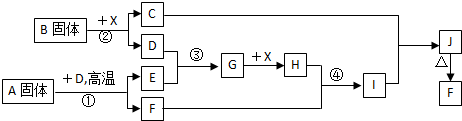
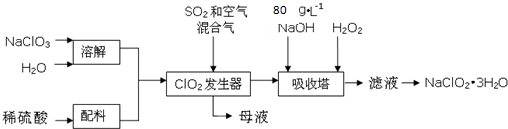
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、250C 时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B、250C 时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C、250C时,Mg(OH)2固体在20ml0.01mol?L-1氨水中的Ksp比在20mL0.01mol?L-1NH4Cl溶液中的Ksp小 |
| D、250C时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12 g金刚石中含有的共价键数为2NA |
| B、22.4LNH3中含有的电子数为10NA |
| C、将1molCl2通入足量水中充分反应达到平衡后转移电子总数为NA |
| D、电解精炼铜时,当电路中转移2NA个电子时粗铜的质量减少64g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com