
I������ͼ��ʾ��������A��װ��20���ˮ50 mL������B��װ��1 mol/L����
��50 mL���Թ�C��D����ͨ��������װ�к���ɫNO2����ɫN2O4�Ļ�����壬����������ƽ
�⣺2NO2? ?N2O4����H����57 kJ/mol��
?N2O4����H����57 kJ/mol��

����A�м���50 gNH4NO3����ʹ֮�ܽ⣻��B�м���2 g������ʱ��
(1)C�е�������ɫ__________�� (���dz�����)��
(2)��25��ʱ����ʼʱ����NO2���壬�ﵽƽ��ʱ��c(NO2)��0.012 5 mol/L��c(N2O4)��
0.0321mol/L����NO2����ʼŨ��Ϊ__________��NO2��ת����Ϊ__________��
��. ����֧�ݻ���Ϊ30cm3��Ͳ�зֱ����10cm3NO2���壬����Ͳǰ�˷�ա�
(1)���ڶ�֧��Ͳ����Ѹ������5cm3������ʱ�������ɫ���һ��ʱ���������ɫ�ֱ�dz�ˣ����Աȵ�һ֧��Ͳ�������ɫ�
�� �ƽ���Ͳ����ɫ�����ԭ���� ��
��һ��ʱ���������ɫ�ֱ�dz��ԭ����
�� �ڴ˹����У��÷�Ӧ�Ļ�ѧƽ�ⳣ���� (���������С�����䡱����ͬ��NO2��ת���ʽ� ��
I.��1����dz ��2��0.0767 mol/L 83.7%
��.��1��������������С��NO2Ũ�������������ɫ����
������ѹǿ����С����������ƽ��������Ӧ�����ƶ� �۲��� ����
��������
���������I.��1�����������ˮ���ȣ��Ҹ÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������C��ƽ��������Ӧ�����ƶ�����ɫ��dz��
��2���ﵽƽ��ʱ��c(NO2)��0.012 5 mol/L��c(N2O4)��0.032 1 mol/L��������NO2��Ũ����0.032 1 mol/L��2��0.0642 mol/L������NO2����ʼŨ����0.012 5
mol/L��0.0642 mol/L��0.0767
mol/L����NO2��ת����Ϊ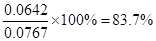 ��
��
��.��1��������������С�����NO2Ũ�����������������ɫ���
������ѹǿ����С����������ƽ��������Ӧ�����ƶ������һ��ʱ���������ɫ�ֱ�dz��
��ƽ�ⳣ��ֻ���¶��й�ϵ�����Ըı�ѹǿ��ƽ�ⳣ�����䣻ƽ��������Ӧ�����ƶ������Է�Ӧ���ת��������
���㣺�������������ƽ��״̬��Ӱ�졢ת���ʵļ���
�������������е��Ѷȵ����⣬����ע�ػ��������������Ŀ����ѵ������������������ѧ������˼ά�����ͷ�ɢ˼ά����������������ѧ���������⡢��������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
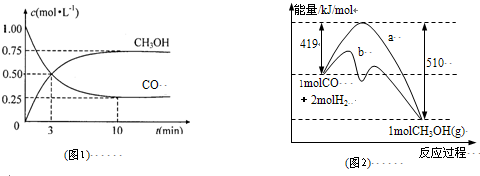
| c(CH3OH) |
| c(CO)��c2(H2) |
| c(CH3OH) |
| c(CO)��c2(H2) |
| n(CH3OH) |
| n(CO) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�걱����101��ѧ�߶���ѧ�����п��Ի�ѧ�Ծ����������� ���ͣ������
��10�֣����ݵ���������Ӧ���Ȼ�ѧ����ʽ�������ж���ȷ����
�� I2��g����H2��g�� 2HI��g����H����9.48 kJ/mol
2HI��g����H����9.48 kJ/mol
�� I2��s����H2��g�� 2HI��g����H����26.48 kJ/mol
2HI��g����H����26.48 kJ/mol
��1��д����̬��������̬����Ȼ�ѧ����ʽ�� ��
��2������Ӧ������52.96kJ����ʱ��ת�Ƶ��ӵ����ʵ����� mol��
��3�������ں��¡������ܱ������н��еķ�Ӧ�٣���˵����ﵽ��ѧƽ��״̬���� ��
A. ����������ѹǿ����
B. �����������ܶȲ���
C. ������������ɫ����dz����
D. ��n��H��H�����ѵ�ͬʱ��2n��H��I������
��4����ͨ����Ӧ2NO��O2��2NO2��NO2��2H����2I����NO��I2��H2O����ȡ�⣬NO���Ƶ�����е������� ��
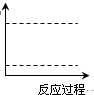
��5�����Ṥҵβ���ж�������ĺ�������0.05%�����������ʱ�辭����������ŷš�ijУ��ѧ��ȤС�����ⶨij���Ṥ���ŷ�β���ж�������ĺ������������·���������ͼ��ʾ��ͼ������������B����ȷ����ͨ����β���������β��ͨ��һ�������֪Ũ�ȵĵ�ˮ�вⶨSO2�ĺ�������ϴ��ƿC����Һ����ɫ��ʧʱ�������رջ���A��
���õ�ˮ�ⶨSO2�ĺ����Ļ�ѧ����ʽ�� ��
��ϴ��ƿC�е���ĩ������һ���������D���������ʵ���ȷ�ȣ��������� ��
��ϴ��ƿC����Һ����ɫ��ʧ��û�м�ʱ�رջ���A����õ�SO2����_________���ƫ�ߡ�����ƫ�͡�����Ӱ�족����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ�����и���3�½�ѧ������⣨һģ����ѧ�Ծ��������棩 ���ͣ������
��ѧ��Ӧԭ���ڿ��к��������й㷺Ӧ�á�
��1�����á���ѧ����ת�Ʒ����ᴿ�����ٵķ�Ӧԭ��ΪW(s)��I2(g) WI2(g) (I)���÷�Ӧ��ʯӢ��չ��н��У�����ͼ��ʾ��
WI2(g) (I)���÷�Ӧ��ʯӢ��չ��н��У�����ͼ��ʾ��
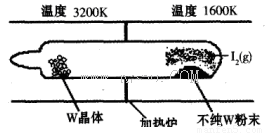
�ٷ�Ӧ(I)��ƽ�ⳣ������ʽK��_______����K�� ����ij�����ܱ������м���1mol I2(g)������W(s)����Ӧ�ﵽƽ��ʱI2(g)��ת����Ϊ__________��
����ij�����ܱ������м���1mol I2(g)������W(s)����Ӧ�ﵽƽ��ʱI2(g)��ת����Ϊ__________��
�ڷ�Ӧ(I)�ġ�H____0���������������������Ӧ��ϵ�п�ѭ��ʹ�õ�������_________��
���ܹ�˵��������Ӧ�Ѿ��ﵽƽ��״̬����_________������ţ���
a��I2��WI2��Ũ�����
b��W���������ٱ仯
c�������ڻ��������ܶȱ��ֲ���
d����λʱ���ڣ����������ĵ����ʵ�����⻯�����ɵ����ʵ������
��2��25��ʱ��NaHSO3��ˮ��ƽ�ⳣ����1.0��10��12mol/L������¶���H2SO3 HSO3����H���ĵ��볣��Ka��____mol/L������H2SO3��Һ�м���������I2������Һ��
HSO3����H���ĵ��볣��Ka��____mol/L������H2SO3��Һ�м���������I2������Һ�� ��________�����������С�����䡱����
��________�����������С�����䡱����
��3��ֱ���ŷź�SO2���������γ����꣬Σ����������Na2SO3��Һ����SO2�Ĺ����У�pH��n��SO32������n(HSO3��)�仯��ϵ���±���
n(SO32��): n ( HSO3��) | 91:9 | 1:1 | 1:91 |
pH(25��) | 8.2 | 7.2 | 6.2 |
������Һ������ʱ����Һ������Ũ���ɴ�С��˳��Ϊ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��㶫ʡ�����и����ڶ��θ߿�ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�������
�ϳɰ�Ȼ������������������Ҫ�Ļ���������
I����3��2 L���ܱ������У�����ͬ���¶��¡�ʹ����ͬ�Ĵ����ֱ���з�Ӧ��
3H2(g) + N2(g) 2NH3(g)������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ�й��������£�
2NH3(g)������ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ�й��������£�
|
|
�� |
�� |
�� |
|
��Ӧ��Ͷ���� |
3 mol H2��2 mol N2 |
6 mol H2��4mol N2 |
2 mol NH3 |
|
�ﵽƽ���ʱ��/min |
|
5 |
8 |
|
ƽ��ʱN2��Ũ��/mol��L��1 |
c1 |
1.5 |
|
|
NH3��������� |
��1 |
|
��3 |
|
��������ܶ�/g��L��1 |
��1 |
��2 |
|
��1���������з�Ӧ�ӿ�ʼ����ƽ��ķ�Ӧ����Ϊv(H2)=___________��
��2���ڸ��¶��¼������з�Ӧ��ƽ�ⳣ��K= (�ú�c1�Ĵ���ʽ��ʾ)��
��3�������ϱ����ݣ����й�ϵ��ȷ����________������ţ���
a��2c1 > 1.5 b��2��1 = ��2 c����3 = ��1
II����ҵ���ð����ϳ����أ�H2NCONH2���ķ�Ӧ�ڽ���ʱ��Ϊ����������
��һ����2NH3(l)��CO2(g) H2NCOONH4 (l) (���������)
��H1
H2NCOONH4 (l) (���������)
��H1
�ڶ�����H2NCOONH4(l) H2O(l)��H2NCONH2(l)
��H2
H2O(l)��H2NCONH2(l)
��H2
��4��ijʵ��С��ģ�ҵ�Ϻϳ����ص���������һ���Ϊ0.5 L�ܱ�������Ͷ��4 mol����1mol������̼��ʵ���÷�Ӧ�и������ʱ��ı仯������ͼI��ʾ��

����֪�ܷ�Ӧ�Ŀ���������һ����������ϳ������ܷ�Ӧ�Ŀ����ɵ� ����Ӧ������
�ڵڶ�����Ӧ��ƽ�ⳣ��K���¶�T�ı仯������ͼII��ʾ�����H2 0��������һ����Ӧ����ʱ����Ũ����������ͼII�л�����һ����ӦK1���¶�T�仯���ߣ���������Ҫ�ı�ע��
��5������������Һ��������������ҵβ���е�NO��NO2������ת��ΪN2��
��������NO��NO2���ߵ����ʵ�����ӦΪ��CO(NH2)2+NO+NO2 =CO2+2N2+2H2O
�÷�Ӧ�е�������Ϊ ��д��ѧʽ����
����֪��N2(g)+O2(g)= 2NO(g) ��H =a kJ��mol��1
N2(g)+3H2(g)= 2NH3(g) ��H2=bkJ�� kJ��mol��1
2H2(g)+O2(g)= 2H2O(g) ��H = c kJ��mol��1
��4NH3(g) +4NO(g) +O2(g)= 4N2(g)+6H2O(g) ��H= ��
������ȼ�ϵ�ؽṹ����ͼ��ʾ���乤��ʱ�����缫��Ӧʽ�ɱ�ʾΪ ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�챱���и߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
��10�֣����ݵ���������Ӧ���Ȼ�ѧ����ʽ�������ж���ȷ����
�� I2��g����H2��g�� 2HI��g�� ��H����9.48 kJ/mol
2HI��g�� ��H����9.48 kJ/mol
�� I2��s����H2��g�� 2HI��g�� ��H����26.48 kJ/mol
2HI��g�� ��H����26.48 kJ/mol
��1��д����̬��������̬����Ȼ�ѧ����ʽ�� ��
��2������Ӧ������52.96kJ����ʱ��ת�Ƶ��ӵ����ʵ����� mol��
��3�������ں��¡������ܱ������н��еķ�Ӧ�٣���˵����ﵽ��ѧƽ��״̬���� ��
A. ����������ѹǿ����
B. �����������ܶȲ���
C. ������������ɫ����dz����
D. ��n��H��H�����ѵ�ͬʱ��2n��H��I������
��4����ͨ����Ӧ2NO��O2��2NO2��NO2��2H����2I����NO��I2��H2O����ȡ�⣬NO���Ƶ�����е������� ��
��5�����Ṥҵβ���ж�������ĺ�������0.05%�����������ʱ�辭����������ŷš�ijУ��ѧ��ȤС�����ⶨij���Ṥ���ŷ�β���ж�������ĺ������������·���������ͼ��ʾ��ͼ������������B����ȷ����ͨ����β���������β��ͨ��һ�������֪Ũ�ȵĵ�ˮ�вⶨSO2�ĺ�������ϴ��ƿC����Һ����ɫ��ʧʱ�������رջ���A��

���õ�ˮ�ⶨSO2�ĺ����Ļ�ѧ����ʽ�� ��
��ϴ��ƿC�е���ĩ������һ���������D���������ʵ���ȷ�ȣ��������� ��
��ϴ��ƿC����Һ����ɫ��ʧ��û�м�ʱ�رջ���A����õ�SO2����_________���ƫ�ߡ�����ƫ�͡�����Ӱ�족����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com