
| A. | 金属的熔点和沸点都很高 | B. | CCl4是含有极性键的非极性分子 | ||
| C. | HF、HCl、HBr、HI的稳定性依次增强 | D. | 第一电离能N<O |
分析 A.常温下Hg为液态;
B.CCl4含C-Cl极性共价键,结构对称;
C.非金属性越强,对应氢化物越稳定;
D.N的2p电子半满为稳定结构,不易失去电子.
解答 解:A.常温下Hg为液态,熔沸点较低,故A错误;
B.CCl4含C-Cl极性共价键,结构对称,为非极性分子,故B正确;
C.非金属性越强,对应氢化物越稳定,则HF、HCl、HBr、HI的稳定性依次减弱,故C错误;
D.N的2p电子半满为稳定结构,不易失去电子,则第一电离能N>O,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握物质的性质、化学键、元素周期律为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 加入过量氨水,有白色沉淀生成,则原溶液中一定有Al3+ | |
| B. | 加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42- | |
| C. | 向某溶液中先加入氯水振荡,再加KSCN溶液后显血红色,该溶液中一定有Fe2+ | |
| D. | 向某溶液中先加入新制饱和氯水,再加CCl4,振荡,分层,下层呈橙红色,则该溶液中一定含有Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
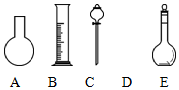 实验室需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.80mol•L-1 NaOH溶液475mL和0.40mol•L-1硫酸500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
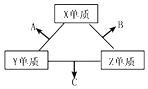 三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化.一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.下列判断正确的是( )
三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化.一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10.下列判断正确的是( )| A. | 原子半径:Z<Y<X | B. | 非金属性 Z>Y>X | ||
| C. | 化合物A易溶于水 | D. | 化合物B与C的混合物呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
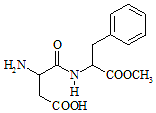 阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )
阿斯巴甜(Aspartame,结构简式如图所示)具有清爽的甜味,甜度约为蔗糖的200倍.下列有关说法正确的是( )| A. | 分子式为C14H18N2O3,阿斯巴甜不属于蛋白质 | |
| B. | 阿斯巴甜的水解产物中只有一种氨基酸 | |
| C. | 阿斯巴甜在一定条件下不能与酸反应、只能与碱反应 | |
| D. | 阿斯巴甜分子中有3个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(ClO-)=1.0mol/L的溶液中:Na+、SO32-、S2-、SO42- | |
| B. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的溶液中:Ca2+、Mg2+、HCO3-、I- | |
| C. | 滴入少量KSCN溶液显红色的溶液中:Na+、K+、I-、SO42- | |
| D. | 由水电离的c(H+)=1×10-12mol/L的溶液中:Ba2+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
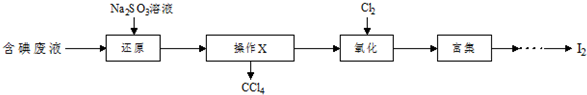
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com