
【题目】亚铁盐在空气中一般都易被氧化,而摩尔盐[(NH4)2SO4FeSO46H2O]比一般的亚铁盐要稳定,但受热时易分解易被氧化。其实验室的制备原理为:FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4FeSO46H2O↓
如图为制取摩尔盐的简要流程:

请回答下列问题:
(1)步骤①中反应容器应尽量避免摇晃或搅拌,目的是___。
(2)步骤②中的操作是加热蒸发、___、___。为什么不能加热蒸干___。
(3)摩尔盐中NH4+、Fe2+、SO42-的检验:
①甲同学提出可以用湿润的___试纸、稀盐酸和___溶液来检验这三种离子。
②乙同学提出检验其中的Fe2+,可以用KSCN溶液和___,预期的现象和结论是___。
③实际操作中,乙同学加人KSCN溶液时,发现溶液变成浅红色,于是他对自己的方法提出了怀疑。丙同学经过仔细思考认为,乙同学的方法是可行的,这是因为___。
(4)丁同学欲测定摩尔盐中Fe2+的含量。他称取了4.0g摩尔盐样品,溶于水,并加入适量稀硫酸,用0.20mol/L的KMnO4溶液滴定,消耗KMnO4溶液10.00mL。
①本实验的指示剂是___(填字母)。
A.酚酞 B.石蕊 C.甲基橙 D.不需要
②KMnO4溶液置于______________ (填“酸式”或“碱式”)滴定管中
③滴定终点的现象是____________________________________________________。
④产品中Fe2+的百分含量是_________________________________。
【答案】防止Fe2+被氧化 冷却结晶 过滤 摩尔盐受热易分解易被氧化 红色石蕊 氢氧化钡 氯水(或双氧水) 加入KSCN溶液无明显现象,再加入氯水,溶液变红,则证明溶液中含有Fe2+ 继续加入氯水后,溶液红色显著加深,则证明溶液中含有Fe2+ D 酸式 滴入最后一滴KMnO4溶液摇匀后,锥形瓶中的溶液由浅绿色变为浅红色,且30 s内不褪色 14%
【解析】
⑴尽量避免摇晃或搅拌,防止Fe2+被氧化。
⑵还需要冷却结晶、过滤;摩尔盐受热易分解易被氧化。
⑶根据题意,铵根与氢氧反应生成氨气可使红色石蕊变蓝,氢氧根与亚铁离子反应,硫酸根用钡离子检验;②氯水(或双氧水)和KSCN溶液检验溶液中含有Fe2+;③利用平衡移动分析继续加入氯水后,溶液红色显著加深。
⑷①KMnO4溶液本身有色,不需要指示剂;②酸性、氧化性试剂应该选择酸式滴定管;③滴入最后一滴KMnO4溶液摇匀后,锥形瓶中的溶液由浅绿色变为浅红色,且30 s内不褪色;④根据电子守恒得出KMnO4 ~5 Fe2+,先求Fe2+的物质的量,再求Fe2+的百分含量。
⑴尽量避免摇晃或搅拌,防止Fe2+被氧化。
⑵还需要冷却结晶、过滤;摩尔盐受热易分解易被氧化。
⑶根据题意,铵根与氢氧反应生成氨气可使红色石蕊变蓝,氢氧根与亚铁离子反应,硫酸根先加氢氧化钡,再加盐酸,有白色沉淀;故答案为:红色石蕊;氢氧化钡。
②氯水(或双氧水),加入KSCN溶液无明显现象,再加入氯水,溶液变红,则证明溶液中含有Fe2+;故答案为:加入KSCN溶液无明显现象,再加入氯水,溶液变红,则证明溶液中含有Fe2+。
③继续加入氯水后,溶液红色显著加深,则证明溶液中含有Fe2+;故答案为:继续加入氯水后,溶液红色显著加深,则证明溶液中含有Fe2+。
⑷①KMnO4溶液本身有色,不需要指示剂;故答案为D。
②酸性、氧化性试剂应该选择酸式滴定管;故答案为酸式。
③滴入最后一滴KMnO4溶液摇匀后,锥形瓶中的溶液由浅绿色变为浅红色,且30 s内不褪色;故答案为:滴入最后一滴KMnO4溶液摇匀后,锥形瓶中的溶液由浅绿色变为浅红色,且30 s内不褪色。
④根据电子守恒KMnO4 ~5 Fe2+,所以![]() ,Fe2+的百分含量为
,Fe2+的百分含量为![]() ;故答案为14%。
;故答案为14%。


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示。请回答:
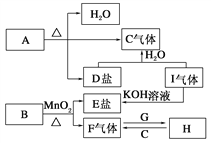
(1)画出G离子结构示意图________;
(2)写出B、I的化学式B________,I________;
(3)写出H的一种用途__________________________________;
(4)写出A受热分解的化学方程式_________________________;
(5)若10g的C6H12O6在氧气中充分燃烧,将产物全部与足量的H充分反应,反应后固体增重____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问題。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)反应方向移动;水的电离程度将________(填“增大”、“减小”或“不变”)。
(2)99℃时,KW=1.0×10-12 mol2·L-2,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______。
②体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度的电荷守恒关系式为__________。
(3)已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
①下列微粒可以大量共存的是________(填字母)。
a.![]() 、
、![]() b.
b.![]() 、
、![]() c.
c.![]() 、
、![]() d.H2SO3、
d.H2SO3、![]()
②已知NaHSO3溶液显酸性,溶液中各离子浓度从大到小的排列顺序是_______。
(4)0.1 mol·L-1的NaHA溶液,测得溶液显碱性。则该溶液中 c(H2A)________c(A2-)(填“>”、“<”或“=”),作出此判断的依据是__________(用文字解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关常见高分子聚合物的说法正确的是
A.苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为![]()
B.聚-1,3-丁二烯(![]() )是一种碳碳双键和碳碳单键1:1依次交替排列的高分子
)是一种碳碳双键和碳碳单键1:1依次交替排列的高分子
C.![]() 是由对苯二甲酸和乙二醇通过缩聚反应得到的
是由对苯二甲酸和乙二醇通过缩聚反应得到的
D.硫化橡胶具有较高的强度和化学稳定性,是一种线型高分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学一选修3:物质结构与性质)
含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为________;基态Cu+的核外电子排布式为___________。
(2)化合物(CH3)3N分子中N原子杂化方式为________,该物质能溶于水的原因是______。
(3)PH3分子的键角小于NH3分子的原因是________________;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为______________________。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
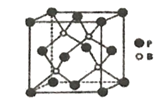
①在一个晶胞中原子的配位数为_______________。
②已知磷化硼晶体的密度为pg/cm3,阿伏加德罗常数为NA,则B-P键长为_________。
③磷化硼晶胞沿着体对角线方向的投影如图,请在答题卡上将表示B原子的圆圈涂黑_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某医药中间体G的一种合成路线如下:
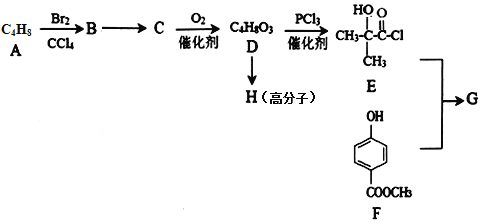
已知:(1)A的核磁共振氢谱有两组峰,且峰面积之比为3∶1;
(2)G的结构简式为:![]() ;
;
(3)![]() 。
。
回答下列问题:
(1)A的名称是_____________;B→C的反应类型是_____________。
(2)G的分子式为___________;G中官能团名称是_____________;1 mol G与NaOH溶液反应最多消耗______ mol NaOH。
(3)H的结构简式为_____________。
(4)D在浓硫酸加热的条件下会生成一种含六元环的化合物,写出该反应的化学方程式_________________________________。
(5)I与F互为同分异构体,则满足下列条件的I的结构有______种(不包括F)。
①苯环上有两个取代基;②遇FeCl3溶液显紫色;③能与NaOH反应。
(6)根据题中所给信息,写出由苯酚,甲苯为原料制备苯甲酸苯酚酯的合成路线(其它无机试剂任选):_________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向 2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表。下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前 50 s 的平均速率v(PCl3)=0.0032 mol·L1·s1
B.该条件下,反应的平衡常数K=0.05
C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L1,则反应的ΔH<0
D.其他条件相同时,向空的容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,此时 v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氯化锡常用作媒染剂、有机合成中的催化剂,已知SnCl4易水解,溶点为-33℃、沸电为114℃。某研究性学习小组设计如图装置(部分夹持装置及加热仪器省略)制备SnCl4。
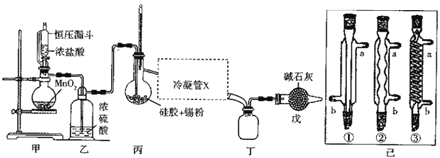
(1)装置甲中反应的离子方程式为___。整个制备装置中有一处不足,改进的方法是___。
(2)利用改进后的装置进行实验(下同)时甲、丙均需加热,首先加热的是___处的烧瓶,冷凝管x是已中的一种,该仪器的编号是___,装置戊的用途是___。
(3)实验过程中装置甲中除观察到固体溶解外,还可观察到的明显变化是___。
(4)该小组的甲同学提出,可利用标准NaOH溶液滴定甲中剩余溶液的方法测定出盐酸与MnO2反应的最低浓度。
①滴定时所用指示剂最好是___[假设开始出现Mn(OH)2,沉淀时的pH约为6.8]。
②假设实验时从甲中准确取出V2 mL剰余溶液并稀释到V3mL,然后用0.1000molL-1的 NaOH溶液进行滴定,滴定终点时消耗掉V1 mLNaOH溶液,则盐酸与MnO2反应时最低浓度应大于___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示。

(1)滤液1中钛元素以TiO2+形式存在,则“溶浸”过程发生的主要反应的化学方程式为________。
(2)物质A为________(填化学式),“一系列操作”为________。
(3)“水解”步骤中生成TiO2·xH2O,为提高TiO2·xH2O的产率,可采取的措施有________、________。(写出两条)。
(4)“电解”是以石墨为阳极,TiO2为阴极,熔融CaO为电解质。阴极的电极反应式为________;若制得金属Ti 9.60g,阳极产生气体________mL(标准状况下)。
(5)将少量FeSO4·7H2O溶于水,加入一定量的NaHCO3溶液,可制得FeCO3,写出反应的离子方程式________;若反应后的溶液中c(Fe2+)=2×10-6mol·L-1,则溶液中c(CO32-)=________mol·L-1。(已知:常温下FeCO3饱和溶液浓度为4.5×10-6mol·L-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com