
 (1)如下图所示,当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:
(1)如下图所示,当容器A中的反应开始后,若分别进行下列操作,请回答有关问题:| 1 |
| 2 |
| 3a+3b |
| 2 |
| 3a+3b |
| 2 |


科目:高中化学 来源: 题型:
| b |
| t |
| b |
| t |

查看答案和解析>>
科目:高中化学 来源: 题型:
(08浙江省开化中学模拟)实验室中根据2SO2+O2![]() 2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
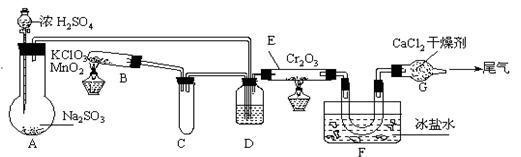
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是
(3)小试管C的作用是
(4)广口瓶D内盛的试剂是 。装置D的三个作用是 ①
② ③
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是
(6)装置F中U型管内收集到的物质的颜色、状态是
(7)装置G的作用是
(8)从G装置导出的尾气处理方法是
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl====2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4====2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是_____________________。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(![]() )。2001年我国卫生部规定,饮用水中
)。2001年我国卫生部规定,饮用水中![]() 的含量应不超过0.2 mg·L-1。
的含量应不超过0.2 mg·L-1。
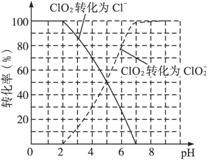
饮用水中ClO2、![]() 的含量可用连续碘量法进行测定。ClO2被I-还原为
的含量可用连续碘量法进行测定。ClO2被I-还原为![]() 、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,
、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2.0时,![]() 也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:
也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:
2Na2S2O3+I2====Na2S4O6+2NaI
①请写出pH≤2.0时,![]() 与I-反应的离子方程式___________________________________。
与I-反应的离子方程式___________________________________。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL。
步骤5:_________________________________。
步骤6:再用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水样中![]() 的浓度为________________mol·L-1 (用含字母的代数式表示)。
的浓度为________________mol·L-1 (用含字母的代数式表示)。
④若饮用水中![]() 的含量超标,可向其中加入适量的Fe2+将
的含量超标,可向其中加入适量的Fe2+将![]() 还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
还原成Cl-,该反应的氧化产物是____________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分).如下图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g)Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
(1)B中X 的转化率α(X)B为
(2)A中W和B中Z的物质的量的比较:n(W)A n(Z)B (填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为 升(用a表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com