
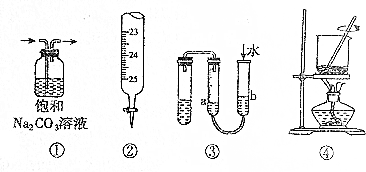
| A. | ①用于除去CO2中的SO2 | B. | ②用于量取20.00mL Na0H溶液 | ||
| C. | ③用于判断装置的气密性 | D. | ④用于将海带燃烧成灰 |
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 晶体硅制作的光导纤维遇强碱会“断路” | |
| B. | 煤的综合利用主要是通过煤的干馏、液化和气化以获得洁净的燃料和多种化工原料 | |
| C. | 氢气燃烧能放出大量的热量,燃烧产物是水,所以是理想的清洁燃料 | |
| D. | 化学电源有一次电池和二次电池之分,一次电池用过之后不能复原 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
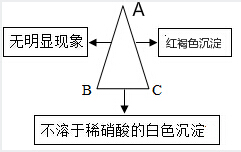 现有A、B、C三种物质,已知A是一种氯化物,B是一种钠盐,C是一种碱,下图表示的是A、B、C的溶液两两混合的实验现象.请回答下列个小题:
现有A、B、C三种物质,已知A是一种氯化物,B是一种钠盐,C是一种碱,下图表示的是A、B、C的溶液两两混合的实验现象.请回答下列个小题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸与碱恰好中和时所放出的热量叫中和热 | |
| B. | 化学反应中能量变化的大小与反应物的质量无关 | |
| C. | 伴有能量变化的过程都是化学变化 | |
| D. | 化学反应中的能量变化,主要是由化学键变化引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与H2化合能力:At2>I2 | B. | 砹在常温下为白色固体 | ||
| C. | 砹原子的最外电子层上有7个电子 | D. | 砹能从NaCl溶液中置换出氯单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com