
| A | | | |||||||||||||||
| B | | | | C | D | E | F | | |||||||||
| G | H | I | J | | K | L | | ||||||||||
| | | | | | M | | | N | | | | | | | | | |
科目:高中化学 来源:不详 题型:单选题
| A.放射性废水的处理方法主要有稀释排放法、放置衰变法、沥青固化法等 |
| B.127I是碘元素稳定的同位素,与131I互为同分异构体 |
| C.1271与131I的质量数不同,它们的化学性质不同 |
| D.137Cs与134Cs称为铯的同素异形体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素编号 | 元素性质或原子结构 |
| T | 原子最外层共有6种不同运动状态的电子 |
| X | 氢化物水溶液呈碱性 |
| Y | 短周期中原子半径最大 |
| Z | 元素最高正价是+3价其最高价氧化物可做耐火材料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| A | 原子的电子排布图为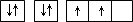 |
| B | 常温下单质为双原子分子,原子间形成三对共用电子对 |
| C | 原子的s轨道电子数等于p轨道电子数,元素的最低负价为-2价 |
| D | 二价阳离子与C的阴离子具有相同的电子层结构 |
| E | 原子序数是D两倍, |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com