
| A.溶液中Na+离子个数为NA(NA表示阿伏加德罗常数) |
| B.溶液中的CO32—离子浓度先增大后减小 |
| C.微热反应后的溶液,溶液的pH会升高 |
| D.当恰好生成Na2CO3时,溶液中离子浓度大小存在以下关系: |
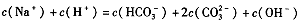
科目:高中化学 来源:不详 题型:单选题
| A.铝热法炼铁:Fe2O3 + 2Al高温 Al2O3 + 2Fe |
B.工业上用NH3制备NO:4NH3 + 5O2 4NO + 6H2O 4NO + 6H2O |
| C.向受酸雨影响的湖泊中喷洒CaCO3粉末:CO32- + 2H+="=" H2O + CO2↑ |
| D.过氧化钠用于呼吸面具中作为氧气的2Na2O2 + 2CO2 ==2Na2CO3 + O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.①③ | B.①②③ | C.①② | D.②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

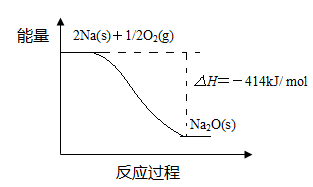
| A.升高温度,溶液的pH降低 |
| B.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3) |
| C.加入少量NaOH固体,c (CO32―)与c (Na+)均增大 |
| D.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+) |
 Ni + 2NaCl。其正极反应式是_____。
Ni + 2NaCl。其正极反应式是_____。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.100mL 0.1mol/L Na2CO3溶液中含有CO32-的数目小于0.01NA |
| B.热的碳酸钠溶液比冷的碳酸钠溶液洗涤餐具效果好 |
| C.用碳酸钠除去锅炉中的水垢(主要成分是CaSO4),使之转化为疏松、易溶于酸的碳酸钙。 |
| D.100mL 0.1mol/L Na2CO3溶液中:n(CO32-)+n(HCO3-)+n(OH?)=0.01mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等质量的Na2CO3、NaHCO3分别与足量稀盐酸反应,NaHCO3产生的CO2多 |
| B.等质量的Na2CO3、NaHCO3分别与足量的同种盐酸反应,NaHCO3消耗的盐酸多 |
| C.向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀 |
| D.Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属钠保存在煤油中 |
| B.钠的密度比水小 |
| C.钠在空气中燃烧生成Na2O |
| D.实验时用剩的钠块应该放回原试剂瓶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.1 g | B.3.6 g |
| C.7.2 g | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
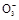
 BaCO3↓+H2O)
BaCO3↓+H2O)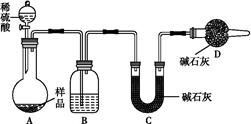
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com