
| A. | 水泥是建筑工业的基础材料,可用黏土、石灰石等原料来制得 | |
| B. | 常温下,二氧化硅可与NaOH溶液反应 | |
| C. | 向硅酸钠溶液中滴加稀盐酸,溶液中不会出现沉淀 | |
| D. | 晶体硅是良好的半导体材料 |
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LCCl4中含有C-Cl键的数目为2NA | |
| B. | NA个D2O分子中,含有10NA个电子 | |
| C. | 117克氯化钠固体中,含有2NA个氯化钠分子 | |
| D. | 32克SO2与足量的O2反应转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 化学式 | 熔点/℃ | 沸点/℃ | 密度/g.cm-3 | 在水中溶解度 |
| 甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 88 | 0.90 | 可溶 |
| A. | 萃取 | B. | 蒸发 | C. | 蒸馏 | D. | 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 用途 | 解释 |
| A | SO2 | 食品漂白剂 | SO2具有还原性 |
| B | NaClO | 消毒剂 | NaClO具有强氧化性,能杀灭细菌 |
| C | Na2CO3 | 中和过多胃酸 | Na2CO3属于碱 |
| D | 浓硫酸 | 干燥剂 | 浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
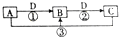 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下,它们之间的相互转化关系如图所示(反应中生成的H2O已略去).请回答下列问题:
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下,它们之间的相互转化关系如图所示(反应中生成的H2O已略去).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 566kJ | B. | 283kJ | C. | 712kJ | D. | 356kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com