
【题目】20℃时,NaCl溶解于水的实验数据如下表所示
实验序号 | 水的质量/g | 加入的NaCl质量/g | 未溶的NaCl质量/g |
10 | 2 | 0 | |
10 | 3 | 0 | |
10 | 4 | 0.4 |
下列叙述正确的是( )
A. 实验①所得的溶液为饱和溶液 B. 实验②所得的溶液为饱和溶液
C. 20℃时NaCl的溶解度为30g D. 实验①所得溶液的溶质质量分数为16.7%
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是:
A. 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C. 滴定时,左手控制滴定管活塞,右手握持锥形瓶边滴边振荡,眼睛注视滴定管中的液面
D. 称量时,称量物质放在称量纸上,置于托盘天平的左盘,砝码放出托盘天平的右盘中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据以下背景资料,回答下列问题:
Ⅰ、不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金。
Ⅱ、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。
Ⅲ、砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
Ⅳ、K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH![]() Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(1)镍元素基态原子的电子排布式为_________________。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为___________,碳原子的轨道杂化类型为_________,所含σ键与π键的数目之比为______________________。
(3)AsCl3分子的立体构型为_____________,铁原子中有_________个未成对电子。
(4)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的原子是_____。
(5)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(6)某镍白铜合金的立方晶胞结构如图所示。
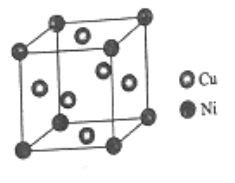
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A,分子式为![]() ,它是具有水果香味的气体,难溶于水,可以发生下列图表中所示的转化:
,它是具有水果香味的气体,难溶于水,可以发生下列图表中所示的转化:
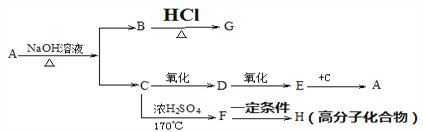
(1)推断有关物质的结构简式:A_________ ,B. ________ , C. __________, G. _________, H. ___________
(2)D与新制Cu(OH)2反应化学方程式:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA
B. 标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数等于2NA
C. NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA
D. 1 mol Fe在氧气中充分燃烧失去3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.标准状况下,11.2LCCl4含有分子数为0.5NA
B.常温常压下,17g氨气中所含原子数为NA
C.1 mol OH- 中含有电子数为10NA
D.1 mol/LBaCl2溶液中含有的氯离子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】组成玉米的主要元素是
A. C、H、Ca、K、Mg、B B. N、P、S、Zn、Cu、Mn
C. C、H、O、P、S、N D. H、O、Fe、B、Zn、Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白。荧光素是发光物质的基质, 5-羧基荧光素与5-羧基二乙酸荧光素在碱性条件下有强烈的绿色荧光,它们广泛应用于荧光分析等。( )

![]()
下列说法不正确的是 ( )
A. 5-FAM转变为5-CFDA属于取代反应
B. 5-FAM的分子式为C21H12O7
C. 5-FAM和5-CFDA 各1mol分别与足量NaOH溶液反应,5-CFDA消耗的NaOH 物质的量多
D. 实验室鉴别5-FAM与5-CFDA可用NaHCO3 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
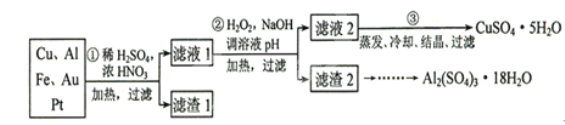
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为___________________________;得到滤渣1的主要成分为__________________________.
(2)第②步加H2O2的作用是_______________;调溶液pH的目的是使______________生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是____________。
(4)探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol· L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2- = CuY2- + 2H+。写出计算CuSO4·5H2O质量分数的表达式ω=_____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com