
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1 mol N-N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则()

A. N4的熔点比P4高
B. 1 mol N4气体转化为N2时要吸收724 kJ能量
C. N4是N2的同系物
D. 1 mol N4气体转化为N2时要放出724 kJ能量
科目:高中化学 来源: 题型:
【题目】只给出下列甲中和乙中对应的量,不能组成一个求物质的量的公式的是( )
甲 | 乙 | |
① | 物质微粒数 | 阿伏加德罗常数 |
② | 标准状况下气体摩尔体积 | 标准状况下气体体积 |
③ | 固体体积 | 固体密度 |
④ | 溶液中溶质的质量分数 | 溶液的体积 |
⑤ | 非标准状况下物质的质量 | 物质的摩尔质量 |
A.③
B.③④
C.②③④
D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍的性质非常相似,它们的化合物应用十分广泛。回答下列问题:
(1)基态铁原子的价电子排布式为_______。铁、钴、镍的基态原子核外未成对电子数最多的是________。
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的[Co(NH3)6]Cl3晶体。该配合物中配体分子的立体构型是_______,其中心原子的杂化轨道类型为_________。
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253K, 沸点为376K,则Ni(CO)4固体属于_____晶体,其中存在的化学键类型为_________。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO_______FeO (填 “>”“<” 或“=”),原因是___________。
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为______,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=_____pm。(写出计算表达式)
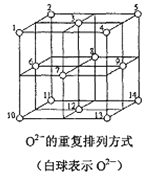
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g)在一可变容积的密闭容器中进行,试回答:
(1)增加Fe的量,其反应速率________(填“增大”、“不变”或“减小”,下同)。
(2)将容器的体积缩小一半,其反应速率____________。
(3)保持体积不变,充入N2使体系压强增大,其反应速率____________。
(4)保持压强不变,充入N2使容器的体积增大,其反应速率____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 4种主族元素,若X的阳离子与Y的阴离子具有相同的电子层结构;W的阳离子的氧化性弱于等电荷数的X阳离子的氧化性;Z的阴离子半径小于等电荷数的Y的阴离子半径,则四种元素的原子序数由大到小的顺序是( )
A. Z X Y W B. W X Y Z C. X Y Z W D. Z Y X W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 需要加热的反应一定是吸热反应
B. 不需要加热的反应一定是放热反应
C. 停止加热,反应就停止,该反应一定是吸热反应
D. 放热反应都会发光并产生火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
[实验一 焦亚硫酸钠的制取]
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2=Na2S2O5。
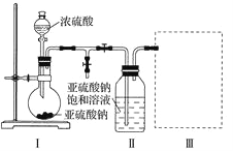
(1)装置Ⅰ中产生气体的化学方程式为____________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是____________________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填字母)。
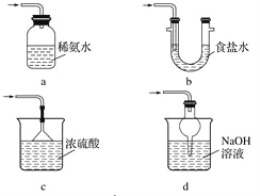
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com