
常温下,下列溶液中一定能大量共存的离子组是( )
A.使pH试纸呈红色的溶液:Na+、Al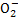 、S
、S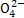 、Cl-
、Cl-
B.澄清透明溶液:Cr2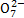 、S
、S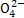 、K+、N
、K+、N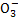
C.pH=0的溶液:Na+、C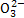 、Fe3+、N
、Fe3+、N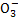
D.水电离产生的c(H+)=1×10-12mol·L-1的溶液:HC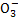 、N
、N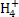 、Cl-、Ca2+
、Cl-、Ca2+
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.若把H2S写成H3S,则违背了共价键的饱和性
B.H3O+的存在说明共价键不应有饱和性
C.所有共价键都有方向性
D.两原子轨道发生重叠后,电子在两核间出现的概率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案不能成功的是( )
A通过测浓度均为0.01 mol·L-1的溶液的pH大小来鉴别盐酸和乙酸
B向均含石蕊的盐酸和乙酸溶液中分别加入NaCl、CH3COONa来鉴别盐酸和乙酸是否为弱电解质
C加热蒸发FeCl3溶液制备FeCl3晶体
D测浓度均为0.1 mol·L-1的NaCl、CH3COONa溶液的pH来鉴别盐酸和乙酸是否为弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。研究小组通过实验确定样品的成分。
查阅资料知:
①Cu2O+2H+===Cu+Cu2++H2O;
②部分氢氧化物在溶液中沉淀的pH见下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
注:金属离子的起始浓度为0.1 mol·L-1
实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为__________________。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是________。
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是__________;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是__________________。
(4)Ⅳ中加NaClO的目的是______________。
(5)由上述实验可以获得结论:原样品所有可能的成分组合为____________;________________。(用化学式表示、任写两种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.[查阅资料]
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀HCl。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置):
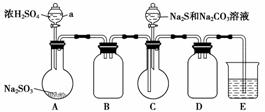
实验步骤:
(1)检查装置气密性,按图示加入试剂。
仪器a的名称是________;E中的试剂是________(选填下列字母编号)。
A.稀H2SO4
B.NaOH溶液
C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中混合物,滤液经__________(填写操作名称)、结晶、过滤、洗涤、干燥,得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。
(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是
________________________________________________________________________。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过________________方法提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列曲线图(纵坐标为沉淀的物质的量,横坐标为加入物的体积)不正确的是
( )
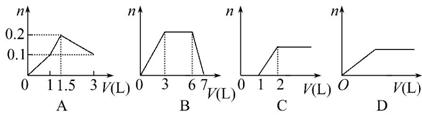
A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合液加入0.1 mol·L-1
稀硫酸
B.向1 L含有0.1 mol·L-1AlCl3和0.3 mol·L-1NH4Cl的混合液中加入0.1 mol·L-1
NaOH溶液
C.向烧碱溶液滴加明矾溶液
D.向AlCl3溶液滴加过量氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2+3H2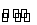 2NH3的正、逆反应速率可用各反应物和生成物浓度的变化来表示。下列各关系中能说明反
2NH3的正、逆反应速率可用各反应物和生成物浓度的变化来表示。下列各关系中能说明反 应已达到平衡状态的是( )
应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于金属腐蚀与防护的说法正确的是( )
A.金属腐蚀就是金属失去电子被还原的过程
B.铝制品的耐腐蚀性强,说明铝的化学性质不活泼
C.将海水中钢铁闸门与电源的负极相连,可防止闸门被腐蚀
D.钢铁锈蚀时,铁原子失去电子成为Fe3+,而后生成Fe(OH)3,再部分脱水成为氧化铁的水合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的化学方程式或离子方程式不正确的是( )
A.工业上可用电解法制备Mg:MgCl2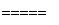 Mg+Cl2↑
Mg+Cl2↑
B.自然界中正常的雨水呈酸性:H2O+CO2H2CO3H++HCO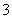
C.石膏粉CaSO4治理盐碱地(含较多可溶性的碳酸盐):
CaSO4(s)+CO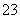 (aq)CaCO3(s)+SO
(aq)CaCO3(s)+SO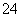 (aq)
(aq)
D.用FeSO4除去酸性废水中的Cr2O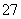 :Cr2O
:Cr2O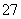 +Fe2++14H+===2Cr3++Fe3++7H2O
+Fe2++14H+===2Cr3++Fe3++7H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com