
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
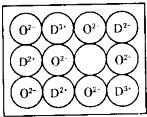 【化学-选修物质结构与性质】
【化学-选修物质结构与性质】查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省达州市高三第一次诊断检测理综化学试卷(解析版) 题型:填空题
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).

(1)E在周期表中的位置 (指明周期和族)。
(2)A、B、C的第一电离能由小到大的顺序为 .
(3)B的氢化物的分子空间构型是 ;AC32-的中心原子采取 杂化.
(4)写出任意一种由两种元素组成的与DC2中的阴离子互为等电子体的微粒的化学式 。
(5)E的高价态离子和低价态离子均能与A、B两元素按原子个数比1:1形成的带一个单位负电荷的阴离子组成六配位的配离子。写出该配离子的化学式 (任写一种).
(6)X是周期表中电负性最大的元素,该元素与D元素组成的离子化合物的晶胞如右图所示。该离子化合物的化学式为 .
查看答案和解析>>
科目:高中化学 来源:2013-2014学年云南省部分名校高三第一次联考(11月)理综化学试卷(解析版) 题型:填空题
已知A、B、C、D、E、F六种短周期元素的性质或结构信息如下表,请根据信息回答下列问题。
元素 性质或结构信息
A 单质常温下为固体,难溶于水易于溶CS2。能形成2种二元含氧酸。
B 原子的M层有1个未成对的p电子。核外p电子总数大于7。
C 单质曾被称为“银色的金子”。与锂形成的合金常用于航天飞行器。单质能溶强酸和强碱。
D 原子核外电子层上s电子总数比p电子总数少2个。单质和氧化物均为空间网状晶体,具有很高的熔、沸点。
E 其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素在三聚氰胺中含量较高。
F 周期表中电负性最大的元素
(1)A原子的最外层电子排布式 ,D原子共有 种不同运动状态的电子。
(2)F与E元素第一电离能的大小关系: > (填元素符号)。
(3)A,B两元素的氢化物分子中键能较小的是 ;分子较稳定的是 。(填分子式)
(4)C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为_________________。
(5)F与钙可组成离子化合物,其晶胞结构如图所示,该化合物的电子式是 。已知该化合物晶胞1/8的体积为2.0×10-23cm3,求该离子化合物的密度,请列式并计算(结果保留一位小数):_______________________。

查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省许昌新乡平顶山高三第一次调研考试理科综合试题(化学部分) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
在A、B、C三种元素中,A元素原子的价电子排布为2s22p5,B元素K、L能层上的电子数与M、N层上的电子数相同。C元素的原子序数等于A、B两元素原子序数之和,C的单质在生产生活中具有许多用途,它可在硫酸铜溶液中用电解法进行精炼。请回答以下问题:
(1)已知C元素的电负性数值为1.9,则A、C两元素的原子之间应形成 键(填“共价”或“离子”);
(2)C元素的价电子排布式为____;
(3)在A元素氢化物的水溶液中,存在有 种不同类型的氢键;
(4)SO42—中S原子的杂化轨道类型是____,SO42—的立体构型是____;
(5)一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是________;
(6)在A、B两元素所形成晶体的晶胞中,位于六面体顶点和面心上的元素为 (填具体的元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com