
 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答:分析 (1)乙池中Fe为阴极上氢离子得电子生成氢气,C为阳极上氯离子失电子生成氯气;
(2)A与负极相连为阴极,B为阳极,阳极上Cu失电子生成铜离子;电解精炼铜时硫酸铜溶液为电解质溶液.
解答 解:(1)乙池中Fe为阴极上氢离子得电子生成氢气,C为阳极上氯离子失电子生成氯气,则电解氯化钠溶液生成氯气、氢气和氢氧化钠,其电极方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+2NaOH+Cl2↑;
故答案为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+2NaOH+Cl2↑;
(2)①A与负极相连为阴极;故答案为:阴极;
②B电极为阳极,阳极上Cu失电子生成铜离子,则电极B反应为Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+;
③电解精炼铜时粗铜作阳极、纯铜作阴极,硫酸铜溶液为电解质溶液,故答案为:硫酸铜溶液.
点评 本题考查了电解池的工作原理的应用,明确电极判断方法、电极反应的书写、电路中电子守恒是解题关键,题目难度不大,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:选择题
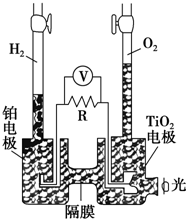 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )| A. | 该装置只能将光能转化为电能 | |
| B. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电源的负极就是阴极 | |
| B. | 与直流电源正极相连的是电解池的阴极 | |
| C. | 与直流电源负极相连的电极上发生还原反应 | |
| D. | 阳极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
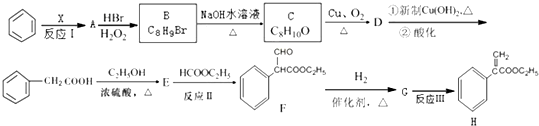
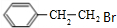 ;E的分子式为C10H12O2;F中含氧官能团的名称是醛基、酯基.
;E的分子式为C10H12O2;F中含氧官能团的名称是醛基、酯基. .
.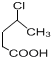 制备
制备 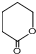 的合成路线流程
的合成路线流程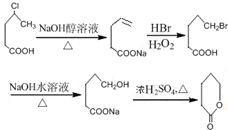 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

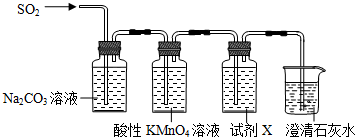
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H3PW12O40在该酯化反应中起催化作用 | |
| B. | 杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质 | |
| C. | H3PW12O40、KH2PW12O40与Na3PW12O40中含有的原子团不同 | |
| D. | 硅钨酸H4SiW12O40也是一种杂多酸,其中W的化合价为+6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2 | B. | Q1=Q2 | C. | 2Q1>Q2 | D. | Q2=Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com