
| A. | 苯和液溴在FeBr3催化作用下生成溴苯 | |
| B. | 丙烯和氯气在一定条件下反应生成ClCH2CH=CH2的反应 | |
| C. | 乙烯使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯与HCl气体反应生成一氯乙烷 |
分析 有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应,据此有机物的结构进行判断.
解答 解:A.苯在铁粉存在下与液溴的反应,苯中H原子被溴原子取代生成溴苯,属于取代反应,故A错误;
B.丙烯和氯气在一定条件下反应生成ClCH2CH=CH2,C=C没有变化,属于取代反应,故B错误;
C.乙烯与高锰酸钾发生氧化反应,不是加成反应,故C错误;
D.乙烯含有碳碳双键,与HCl反应生成一氯代烷,为加成反应,故D正确.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,题目难度不大,侧重于有机物反应类型的判断,注意把握有机物的官能团的性质以及转化,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 解释或结论 |
| A | 向某溶液中逐渐通入CO2气体,先出现白色沉淀,继续通入CO2气体,白色沉淀不溶解,证明该溶液中存在AlO2- | Al(OH)3是两性氢氧化物,不溶于碳酸溶液. |
| B | 某无色晶体加入NaOH浓溶液中并加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 该晶体中一定有NH4+ |
| C | 用蒸馏法能将溶解在CCl4中的碘单质分离出来 | 因为碘易升华,故蒸馏时先分离出来 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,则溶液变为黄色 | 氧化性:H2O2>F e3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
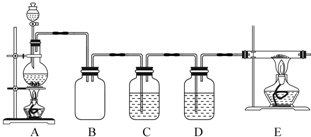
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 | |
| B. | O2前面的$\frac{1}{2}$表示参加反应的O2的分子数目 | |
| C. | 燃烧热是以在101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量定义的,则 H2的燃烧热为285.8 kJ•mol-1 | |
| D. | 1 mol H2和$\frac{1}{2}$ mol O2所具有的总能量大于1mol H2O(g)所具有的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
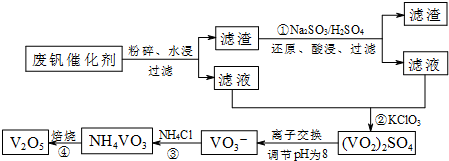
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,下列叙述中正确的是( )
,下列叙述中正确的是( )| A. | 1mol胡椒酚最多可与5molH2发生反应 | |
| B. | 1mol胡椒酚最多可与4mol溴发生反应 | |
| C. | 胡椒酚中所有原子可以共平面 | |
| D. | 胡椒酚在水中的溶解度小于苯酚在水中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4 (C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | NH4Cl溶液 (FeCl3) | NaOH溶液 | 过滤 |
| C | 乙酸乙酯 (乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
| D | C2H5OH (H2O) | 新制生石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com