
分析 在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;
在水溶液里和熔融状态下都不能导电的化合物是非电解质,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
物质导电的条件:含有自由移动的离子或自由电子.
解答 解:①NaOH溶液含有自由移动的离子,能导电;属于混合物,既不是电解质,也不是非电解质;
②干冰不含有自由移动的离子或自由电子,不导电;本身不能电离,属于非电解质;
③稀硫酸有自由移动的离子,能导电;属于混合物,既不是电解质,也不是非电解质;
④铜含有自由电子,能导电;属于单质,既不是电解质,也不是非电解质;
⑤氯水,含有自由移动的离子,能导电;属于混合物,既不是电解质,也不是非电解质;
⑥BaSO4固体,不含有自由移动的离子或自由电子,不导电;熔融状态下能够导电,属于电解质;
⑦蔗糖不含有自由移动的离子或自由电子,不导电;在水溶液里和熔融状态下都不能导电的化合物是非电解质;
⑧食盐晶体 不含有自由移动的离子或自由电子,不导电;在水溶液里或熔融状态下能导电的化合物是电解质;
⑨酒精不含有自由移动的离子或自由电子,不导电;在水溶液里和熔融状态下都不能导电的化合物是非电解质;
⑩熔融的KNO3含有自由移动的离子,能导电;在水溶液里或熔融状态下能导电的化合物是电解质;
所以:其中属于电解质的是:⑥⑧⑩;属于非电解质的是:②⑦⑨;能导电的是:①③④⑤⑩;
故答案为:⑥⑧⑩;②⑦⑨;①③④⑤⑩.
点评 本题考查了电解质、非电解质判断,溶液导电性的判断,明确电解质、非电解质概念及物质导电条件是解题关键,注意导电的不一定是电解质,电解质不一定导电,电解质、非电解质都是化合物,题目难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
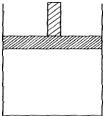 150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度.平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5.
150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度.平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和己烷(溴水) | B. | 乙醛和丙烯酸(KMnO4溶液) | ||
| C. | 矿物油和植物油(NaOH溶液) | D. | 硝基苯和CCl4(水) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液中:Na+、Fe3+、SO42-、Cl- | |
| B. | 饱和氯水中:K+、Na+、Cl-、HSO3- | |
| C. | 室温下,pH=13的溶液中:Na+、K+、SiO32-、Cl- | |
| D. | 1.0mol/L的KNO3溶液:H+、Fe2+、Cl-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LCO质量为28g | |
| B. | 1mol/L的氯化钠溶液中含有1molNa+ | |
| C. | O2的摩尔质量是32 | |
| D. | 14g N2的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | C(SO42- )为0.02mol/L | B. | 100mL溶液中含有0.01mol Al3+ | ||
| C. | 溶液中一定存在Na+ | D. | 无法确定是否含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非自发反应一定不能实现 | |
| B. | 同种物质气态时熵值最小,固态时熵值最大 | |
| C. | 恒温恒压下,△H<0且△S>0的反应一定不能自发进行 | |
| D. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同体积,PH值均为2的盐酸和醋酸分别与NaOH反应,消耗NaOH一样多 | |
| B. | pH=4的醋酸与PH=10的NaOH溶液等体积混合后,PH<7 | |
| C. | 将1 L 0.1 mol•L-1的Ba(OH)2溶液稀释为2 L,pH=12 | |
| D. | pH=8的NaOH溶液稀释100倍,其pH=6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com