
 ,D的简单气态氢化物的空间构型为三角锥形.
,D的简单气态氢化物的空间构型为三角锥形.分析 A、B、C、D、E是五种短周期元素,A元素在地壳含量中排名第二,则A为Si元素;A、B、C、E同周期,则四种元素都位于第三周期,B是同周期第一电离能最小的元素,则B为Na元素;C原子的最外层有三个未成对电子,则C为P元素;C、D同主族,则D为N元素;E单质常温下为淡黄色固体,则E为S元素;F是过渡元素,F的外围电子排布式为3d64s2,F的核外电子排布式为1s22s22p63s23p63d64s2,则F为Fe元素,据此进行解答.
解答 解:A、B、C、D、E是五种短周期元素,A元素在地壳含量中排名第二,则A为Si元素;A、B、C、E同周期,则四种元素都位于第三周期,B是同周期第一电离能最小的元素,则B为Na元素;C原子的最外层有三个未成对电子,则C为P元素;C、D同主族,则D为N元素;E单质常温下为淡黄色固体,则E为S元素;F是过渡元素,F的外围电子排布式为3d64s2,F的核外电子排布式为1s22s22p63s23p63d64s2,则F为Fe元素,
(1)根据分析可知,A为硅元素,B为钠元素,
故答案为:硅;钠;
(2)B、C、E分别为Na、P、S元素,同一周期元素,元素的第一电离能随着原子序数增大而增大,则三种元素的第一电离能由大到小的顺序是:P>S>Na,
故答案为:P>S>Na;
(3)D为N元素,其单质为氮气,氮气分子中含有氮氮三键,其电子式为 ;N的简单气态氢化物为氨气,氨气为三角锥形结构,
;N的简单气态氢化物为氨气,氨气为三角锥形结构,
故答案为: ;三角锥形;
;三角锥形;
(4)F为Fe元素,原子序数为26,位于周期表中第四周期第ⅤⅢ族,Fe3+的核外电子总数为23,其核外电子排布式为:[Ar]3d5或1s22s22p63s23p63d5,
故答案为:第四周期第ⅤⅢ族;[Ar]3d5或1s22s22p63s23p63d5.
点评 本题考查位置、结构与性质关系的综合应用,题目难度中等,推断元素为解答关键,注意掌握常见化学用语的书写原则及元素周期律内容、元素周期表结构,试题有利于提高学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
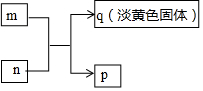 X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W同主族,W的最外层电子数为Z的2倍,m、n分别是X、Y与W形成的化合物,m、n有如图所示的转化关系,p为常见的液态化合物,q是W的单质.下列说法不正确的是( )
X、Y、Z、W是原子序数依次增大的短周期主族元素,其中Y、W同主族,W的最外层电子数为Z的2倍,m、n分别是X、Y与W形成的化合物,m、n有如图所示的转化关系,p为常见的液态化合物,q是W的单质.下列说法不正确的是( )| A. | 原子半径:Z>W>Y>X | |
| B. | 简单氢化物的稳定性:Y>W | |
| C. | m、n、p均为只含极性键的共价化合物 | |
| D. | Z、W形成的化合物可由两种盐溶液通过复分解反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
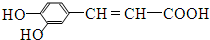 .下列有关说法中正确的是( )
.下列有关说法中正确的是( )| A. | 分子中含有四种官能团 | |
| B. | 可以用酸性高锰酸钾溶液检验碳碳双键 | |
| C. | 1mol咖啡酸与足量钠、碳酸氢钠溶液反应,在相同条件下生成气体的体积比为1:2 | |
| D. | 1mol咖啡酸可与4mol Br2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体是一种液态混合物,属于分散系的一种 | |
| B. | 用丁达尔效应可区分Fe(OH)3胶体、水、CuSO4溶液 | |
| C. | 用过滤器可以将胶体和溶液分开 | |
| D. | 胶体的本质特征是发生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
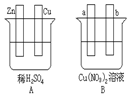 按要求对图中两极进行必要的联接并填空:
按要求对图中两极进行必要的联接并填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m>n | B. | m<n | C. | m=n | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com