
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下左图,电池的工作原理如下图。下列有关说法错误的是
(已知F=96500 C/mol)
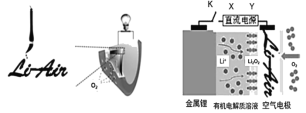
A.放电时,纸张中的纤维素作为电池的正极导电材料
B.充电时,若阳极放出1 mol O2,则有4 mol e-从X电极流出
C.放电时,理论上1 g负极材料能释放的电量约为13786 C
D.充电时,若用铅蓄电池作直流电源,则Y电极材料为PbO2
 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】碳酸镧![]() 可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl3+6NH4HCO3═La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl3+6NH4HCO3═La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
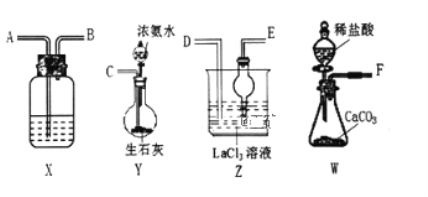
(1)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→_____→_____→_____→_____→_____;__________
(2)Y中发生反应的化学反应式为_______________;
(3)X中盛放的试剂是___________,其作用为___________________;
(4)Z中应先通入NH3,后通入过量的CO2,原因为__________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是一种重要的资源。A~F是常见有机物,它们之间的转化关系如图1所示(部分产物和反应条件已略去),其中A的产量可以用来衡量一个国家的石油化工发展水平,E是最简单的芳香烃。回答下列问题:

(1)步骤②所用试剂X为___________(写化学式),D的官能团名称是_______;
(2)F的结构简式为________________,步骤①的反应类型:___________;
(3)写出下列步骤中的化学方程式(注明反应条件):
步骤③_____________________________________;
步骤④_______________________________________;
(4)用图2所示实验装置制取乙酸乙酯。请回答:试管b中所装溶液应为_____,乙酸乙酯生成后,分离出产品时的操作方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉与水蒸气反应的实验如图所示:
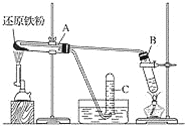
请回答下列问题:
(1)实验时,用酒精喷灯加热还原铁粉,观察到的实验现象是_________。
(2)若将C试管收集满的气体点燃,观察到的实验现象是_____________。
(3) A试管中反应的化学方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是氧化铝(Al2O3),在工业上是采用电解氧化铝的方法得出金属铝。
(1)在氧化铝中铝元素与氧元素的质量之比是__________?
(2)用两种方法计算用170 t含氧化铝80%的铝土矿,理论上可冶炼出金属铝__________吨?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属和金属单质以及相关化合物有着广泛的应用,回答下列相关问题:
(1)铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是______(填字母)。
a. 电子从基态跃迁到较高的激发态 b. 电子从较高的激发态跃迁到基态
c. 焰色反应的光谱属于吸收光谱 d. 焰色反应的光谱属于发射光谱
(2)In元素基态原子的价电子排布式为________。与Cu元素同周期,且基态原子有2个未成对电子的过渡元素是____(填元素符号)。
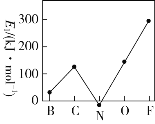
(3)第一电子亲和能(E1)是元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量。第二周期部分元素的E1变化趋势如图所示。试分析碳元素的E1较大的原因:______________。
(4)[PtCl4(NH3)2]中H-N-H键之间的夹角____(填“>”“<”或“=”)NH3分子中H-N-H键之间的夹角,原因是________________。
(5)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4。1个Fe(CO)5分子中含有σ键数目为____;已知Ni(CO)4分子为正四面体构型,下列溶剂能够溶解Ni(CO)4的是____(填字母)。
A. 四氯化碳 B.苯 C.水 D.液氨
(6)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和由3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为____。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18 g·cm-3,则该晶胞参数a=_____cm(写出计算表达式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙可以用于改善地表水质,处理含重金属元素废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如图:

已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是___。
(2)检验“水洗”操作滤液中是否含Cl-,的正确操作是___。
(3)沉淀时常用冰水控制温度在0℃左右有利于提高CaO2·8H2O产率,其可能原因是(写出两种)①___;②___。
(4)测定产品中CaO2含量的实验步骤:
第一步:准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,
再滴入少量2mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液
VmL。(已知:I2+2S2O32-=2I-+S4O62-)
①CaO2的质量分数为___(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能___(填“不变”、“偏低”或“偏高”),原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)回答下列问题:已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=______kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=_______kJ·mol-1。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式_________________。
(3)已知常温时红磷比白磷稳定,已知:
①P4(白磷,s)+5O2(g)===2P2O5(s)ΔH1
②4P(红磷,s)+5O2(g)===2P2O5(s)ΔH2
比较反应中ΔH的大小:ΔH1_______ΔH2(填“>”、“<”或“=”)。
(4)已知:稀溶液中,H+(aq)+OH﹣(aq)===H2O(l)ΔH=﹣57.3 kJ![]() ,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。
,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com