
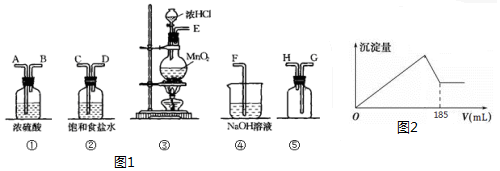
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O分析 (1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气;
(2)浓硫酸的作用是除去氯气中的氯化氢气体;吸收过量的氯气,防止污染空气;
(3)据Cl2+2KI=I2+2KCl分析有碘单质生成,因此淀粉变蓝:
(4)①发生装置中是二氧化锰和浓盐酸加热反应生成氯化锰、氯气与水;
②氯气有毒用氢氧化钠溶液吸收,氯气和氢氧化钠反应生成氯化钠、次氯酸钠;
Ⅱ.设有xmolAl3+,ymolFe3+,则x+y=0.05确立等式①,再由方程式Fe3++3oH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O确定Al3+,Fe3+与OH-的关系建立等式②联立方程组即得x
解答 解:(1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气,装置连接顺序是:E接C;D接A;B接G:H接F;
答案为:C D A B G H F;
(2)浓硫酸的作用是除去氯气中的氯化氢气体;NaOH的作用是吸收过量的氯气,防止污染空气;
故答案为:除去氯气中的H2O(g);吸收过量的氯气
(3)①发生装置中是二氧化锰和浓盐酸加热反应生成氯化锰、氯气与水,反应方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②氯气有毒用氢氧化钠溶液吸收,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
Ⅱ.由图象可知氢氧化铝完全沉淀时消耗185mL氢氧化钠,即消耗0.185molNaOH,设含有xmolAl3+,ymolFe3+,涉及离子方程式为
Fe3++3OH-=Fe(OH)3↓、
y 3y
Al3++4OH-=AlO2-+2H2↑
x 4x
即 x+y=0.05①
4x+3y=0.185②
联立方程组解之得x=0.035 y=0.015 故答案为:0.035mol
点评 本题考查氯气的实验室制备,明确制备原理是解题关键,题目难度不大,旨在考查学生对基础知识的掌握.


科目:高中化学 来源: 题型:多选题
| A. | 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类数相同 | |
| B. | 乙烷、苯、裂化汽油溶液均不能使酸性高锰酸钾溶液褪色 | |
| C. | Na在Cl2中燃烧的生成物含离子键,所以NaCl固体可导电 | |
| D. | 乙醇的沸点比乙酸的沸点低,所以乙醇和乙酸可通过蒸馏初步分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都含有碳、而且碳原子有四个价电子,碳原子间以及碳与其他原子间结构多样 | |
| B. | 它们反应很复杂 | |
| C. | 制取它们的方法很多 | |
| D. | 它们都是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
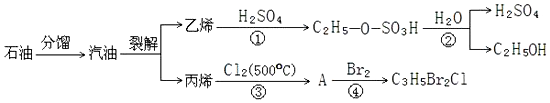
| A. | 石油分馏和裂解均属于化学变化 | |
| B. | 反应①②表明硫酸可用于乙烯水化法制乙醇的催化剂 | |
| C. | 反应①与反应④均属于加成反应 | |
| D. | 反应③的原子利用率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,说法正确的是( )
,说法正确的是( )| A. | 贝诺酯分子中有三种含氧官能团 | |
| B. | 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 | |
| C. | 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 | |
| D. | 贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
| 压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
| A. | 当容器中气体的压强保持不变时,说明该反应已达平衡 | |
| B. | 0~20min内,以CO表示的平均反应速率为0.0125mol•L-1•min-1 | |
| C. | 该温度下平衡常数K的数值为16 | |
| D. | 升高温度,K值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①的平衡常数K1=$\frac{c(C{O}_{2})•c(Cu)}{c(CO)•c(CuO)}$ | |
| B. | 反应③的平衡常数K=$\frac{{K}_{1}}{{K}_{2}}$ | |
| C. | 对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值 | |
| D. | 对于反应②,恒温恒容时,若加入CuO,平衡向正向移动,H2的浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3molH2+1molN2 | B. | 2molNH3+1molN2 | ||
| C. | 2molN2+3molH2 | D. | 0.1molNH3+0.95molN2+2.85molH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com