
| 主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 2 | ① | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | |||||
分析 由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Ne、⑥为Na、⑦为Al、⑧为S,⑨为Cl.
(1)同一周期的元素的原子从左到右,原子半径逐渐减小,而稀有气体的原子的半径最大,同主族自上而下半径逐渐增大;
(2)周期表中,从左到右氧化性逐渐增强,从下到上氧化性逐渐增强;
(3)周期表中,从左到右最高价氧化物的水化物碱性逐渐减弱,从下到上最高价氧化物的水化物碱性逐渐减弱;
(4)Ne形成的单质为Ne;
(5)氢氧化铝为两性氢氧化物.
解答 解:由元素在周期表中位置,可知①为C、②为N、③为O、④为F、⑤为Ne、⑥为Na、⑦为Al、⑧为S,⑨为Cl,
(1)根据同一周期的元素的原子从左到右,原子半径逐渐减小,而稀有气体的原子的半径最大,同主族自上而下半径逐渐增大,)①②⑥⑦中原子半径最小的是N,
故答案为:N;
(2)周期表中,氧化性最强的元素位于最右上角,所以氧化性最强的单质是F2,故答案为:F2;
(3)周期表中,从左到右最高价氧化物的水化物碱性逐渐减弱,从下到上最高价氧化物的水化物碱性逐渐减弱,所以NaOH的碱性最强,故答案为:NaOH;
(4)Ne形成单原子分子Ne,故答案为:Ne;
(5)Al的氢氧化物Al(OH)3和强酸强碱反应都生成盐和水,故答案为:Al.
点评 本题考查了元素周期表和元素周期律综合应用,根据元素周期表结构及元素位置推断元素,再结合物质性质分析解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH${\;}_{4}^{+}$ | SO${\;}_{4}^{2-}$ | NO3 | Cl- |
| 浓度/mol•L-l | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
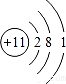 ,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)
,其中三种主族元素的离子半径从大到小的顺序是N3->O2->Na+ (用离子符号表示)
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g氨水中含10gNH3•H2O | B. | 10gNH3溶于水形成100g溶液 | ||
| C. | 100g氨水中含10gNH3 | D. | 10gNH3溶于100gH2O形成的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④ | C. | ①②③ | D. | 只有② |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑥ | C. | ②④⑤ | D. | ②④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com