
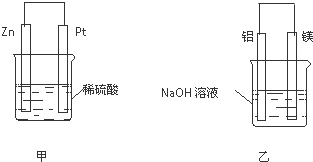
分析 (1)旧键断裂要吸收能量,新键生成要释放能量,当旧键断裂吸收的能量大于新键生成释放的能量时,反应为吸热反应,反之则为放热反应;
(2)甲中锌失电子作负极;溶液中阳离子向正极移动;乙中Al在负极失电子生成偏铝酸根离子.
解答 解:(1)旧键断裂要吸收能量,新键生成要释放能量,氢气和碘反应生成2molHI是,旧键断裂吸收能量的值为:436kJ+151kJ=587KJ,新键生成释放能量为:299kJ×2=598KJ,旧键断裂吸收的能量小于新键生成释放的能量,反应为放热反应,则由氢气和碘单质反应生成1mol HI需要:$\frac{1}{2}$×(598KJ-587KJ)=5.5KJ,
故答案为:吸收能量;放出能量;放出;5.5;
(2)甲中锌失电子作负极,则负极的电极反应为:Zn-2e-=Zn2+;Zn、Cu、稀硫酸形成的原电池中,Zn为负极,Cu为正极,溶液中阳离子向正极移动;乙中Al在负极失电子生成偏铝酸根离子,Al元素的化合价升高被氧化发生氧化反应;
故答案为:Zn-2e-=Zn2+;正;负;氧化.
点评 本题考查了化学反应中的能量变化、原电池原理的应用,题目难度不大,侧重于基础知识的考查,注意把握由键能计算反应热的方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| B. | 制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| C. | 制乙炔时,用排水法或向上排空气法收集气体 | |
| D. | 制一氧化氮时,用排空气法收集气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:[已知:含Al3+溶液中加氢氧化钠溶液先生成Al(OH)3沉淀,加氢氧化钠溶液过量沉淀会溶解,反应方程式:Al(OH)3+NaOH=NaAlO2+2H2O]
已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:[已知:含Al3+溶液中加氢氧化钠溶液先生成Al(OH)3沉淀,加氢氧化钠溶液过量沉淀会溶解,反应方程式:Al(OH)3+NaOH=NaAlO2+2H2O]查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化合物A(C4H10O)是一种有机溶剂.A可以发生以下变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生以下变化:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重金属离子可导致蛋白质盐析 | |
| B. | 芳香烃就是苯和苯的同系物 | |
| C. | SO2和NxOy都属于酸性氧化物 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水、硝酸银溶液、稀硝酸 | B. | 水、氢氧化钠溶液、盐酸 | ||
| C. | 水、氢氧化钾溶液、盐酸 | D. | 水、氢氧化钾溶液、硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把a L0.1mol•L-1的CH3COOH溶液与bL 0.1mol•L-1的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | 把0.1mol•L-1的NaHCO3溶液与0.3mol•L-1的Ba(OH)2溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba2+)>c(Na+)>c(H+) | |
| C. | 向1mol•L-1的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | |
| D. | 常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com