
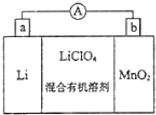
 锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
| ||
| ||


科目:高中化学 来源: 题型:
| A、1、6 | B、2、7 |
| C、2、6 | D、1、7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
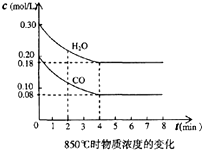 在体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
在体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:
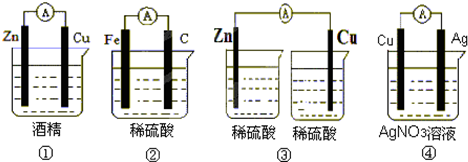
查看答案和解析>>
科目:高中化学 来源: 题型:
A Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
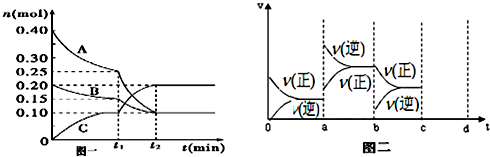
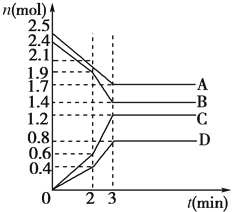 在某一容积为2L的密闭容器中,A、B、C、D四种气体物质的量(n)随时间(t)的变化曲线如图所示:
在某一容积为2L的密闭容器中,A、B、C、D四种气体物质的量(n)随时间(t)的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| X | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Y | 其某种核素不含中子 |
| Z | 失去一个电子后,形成Ne原子电子层结构 |
| W | 最外层电子数是次外层电子数的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com