
| ||
| ||
| ||
| ||
| 8×63 |
| 3×56 |
| 3 |
| 1 |
| n(B) |
| n(A) |
| 4×63 |
| 1×56 |
| 9 |
| 2 |
| 3 |
| 1 |
| n(B) |
| n(A) |
| 9 |
| 2 |


科目:高中化学 来源: 题型:
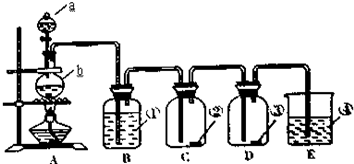
查看答案和解析>>
科目:高中化学 来源: 题型:
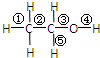 乙醇是一种无色、有特殊香味的液体,是一种重要的有机溶剂和化工原料.其结构如图.其中①②③④⑤表示甲基的C-H键、C-C键、C-O键、O-H键和亚甲基的C-H键.
乙醇是一种无色、有特殊香味的液体,是一种重要的有机溶剂和化工原料.其结构如图.其中①②③④⑤表示甲基的C-H键、C-C键、C-O键、O-H键和亚甲基的C-H键.查看答案和解析>>
科目:高中化学 来源: 题型:
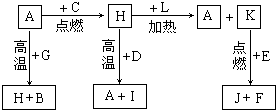 A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,K、L是无色气体,且K是非极性分子,F、H是黑色晶体.以上物质相互间的转化关系如图所示:
A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻.G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,K、L是无色气体,且K是非极性分子,F、H是黑色晶体.以上物质相互间的转化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都呈透明的红褐色 |
| B、分散质颗粒直径相同 |
| C、都比较稳定,密封保存一段时间都不会产生沉淀 |
| D、都能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:2:3 |
| B、2:2:3 |
| C、1:1:1 |
| D、3:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com