
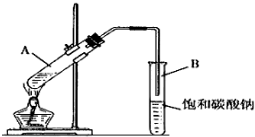
 (1)写出制取乙酸乙酯的化学反应方程式CH3COOH+CH3CH2OH
(1)写出制取乙酸乙酯的化学反应方程式CH3COOH+CH3CH2OH CH3COOC2H5+H2O;
CH3COOC2H5+H2O;分析 (1)酯化反应的本质为酸脱羟基,醇脱氢,在A中反应生成乙酸乙酯和水,且为可逆反应;
(2)从浓硫酸溶于水放热和加热时试管内液体的体积不超过试管容积的1/3”分析,加入药品时,为防止酸液飞溅,应先加入乙醇再加入浓硫酸和乙酸;
(3)乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(4)用饱和碳酸钠溶液吸收乙酸乙酯,乙醇溶解,碳酸钠与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度;
(5)根据粗产品乙酸乙酯、乙酸和乙醇的混合物中各自的性质,进行解答;
(6)根据化学平衡状态的特征分析,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、质量、体积分数以及百分含量不变,以及由此衍生的一些量也不发生变化.
解答 解:(1)酯化反应的本质为酸脱羟基,醇脱氢,在A中乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(2)浓硫酸溶于水放出大量的热,乙醇中含有少量水,应将浓硫酸加入到乙醇中,防止硫酸溶解时放出大量的热导致液体飞溅,另外,加热时,试管内液体的体积不超过试管容积的1/3”,加入药品的顺序为在一个30mL大试管中注入3mL乙醇,再分别缓缓加入2mL浓硫酸和3mL乙酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀(药品总用量不能超过10mL),
故答案为:在一个30 mL的大试管中注入3 mL乙醇,再分别缓缓加入2 mL浓硫酸、3mL乙酸(乙醇和浓硫酸的加入顺序不可互换),边加边振荡试管使之混合均匀;
(3)乙酸与乙醇发生酯化反应,该反应为可逆反应,需浓硫酸作催化剂,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,故浓硫酸的作用为催化剂、吸水剂,
故答案为:催化作用、吸水作用;
(4)乙醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯;
故答案为:吸收除去挥发出来的乙酸和乙醇、降低乙酸乙酯的溶解度;
(5)乙酸乙酯中混有乙醇和乙酸,二者易溶于水而产生倒吸,导管不能插入到Na2CO3溶液中,防止倒吸回流现象的发生,
故答案为:防止倒吸;
(6)①单位时间内生成1mol乙酸乙酯,同时生成1mol水,都表示正反应速率,不能说明到达平衡状态,故①错误;
②单位时间内生成1mol乙酸乙酯表示正反应,同时生成1mol乙酸表示逆反应,说明正逆反应速率相等,反应达到平衡状态,故②正确;
③单位时间内消耗1mol乙醇,同时消耗1mol乙酸,都表示正反应速率,不能说明到达平衡状态,故③错误;
④当反应达到平衡状态时,正逆反应速率相等,故④正确;
⑤当反应达到平衡状态时,混合物中各物质的浓度不再变化,故⑤正确.
故选②④⑤.
点评 本题考查乙酸乙酯的制备,题目难度不大,注意理解饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用系统命名:CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | |
| B. | 2-甲基戊烷和2,2-二甲基丁烷互为同分异构体,C2H6和C3H8一定互为同系物 | |
| C. | 将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 | |
| D. | 糖类、油脂和蛋白质均可发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
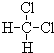 和
和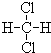 ;
;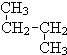 和
和 ⑦CH3 (CH2) 3CH3和
⑦CH3 (CH2) 3CH3和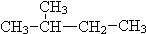
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜丝在乙醇中变黑 | B. | 铜丝点燃后变红 | ||
| C. | 反应中产生黑烟 | D. | 铜丝在乙醇中变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)$?_{453~473K}^{323~353K}$Ni(CO)4(g)
如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)$?_{453~473K}^{323~353K}$Ni(CO)4(g)| A. | 在石英管右端主要物质是Ni(CO)4(g) | |
| B. | 在石英管右端主要物质是纯Ni(s)和CO(g) | |
| C. | 在石英管左端主要物质是纯Ni(s)和CO(g) | |
| D. | 整个过程可以看作CO(g)将Ni(s)从石英管左端转移到右端,从而达到提纯目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| n(CO2)(mol) | 1 | 1.5 | 2 | 3 |
| n(沉淀)(mol) | 0.5 | 1 | 1.5 | 1 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
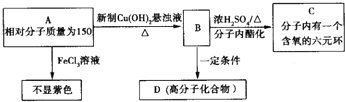
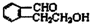 ;
;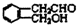 .
. ;此A对应的B生成C的反应:
;此A对应的B生成C的反应: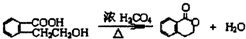 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com