
【题目】以下哪种仪器是配制100mL1mol·L-1NaOH溶液过程中不需要使用的
A.烧杯B.100mL容量C.玻璃棒D.蒸发皿
科目:高中化学 来源: 题型:
【题目】一定温度下在容积为5L的密闭容器中,通入5 molN2和8 molH2,在一定条件下反应生成NH3,当反应进行到2 min时,测得容器内有4 molNH3。则:
(1)求2 min内,H2的平均反应速率。_____
(2)求2min时N2的转化率。______
(3)2 min时,求容器内气体的压强与反应前气体压强的比值。(不用写计算过程)___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列指定条件的溶液中,一定能大量共存的离子组是()
A. ![]() 溶液中:
溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B. 无色溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
C. 室温下,![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]() .
.
D. 滴入KSCN溶液显红色的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如图4所示:
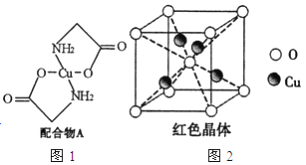
(1)Cu元素基态原子的外围电子排布式为______________。
(2)元素C、N、O的第一电离能由大到小排列顺序为_______________。
(3)配合物A中碳原子的轨道杂化类型为_______________________。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有![]() 键的数目为____________mol。
键的数目为____________mol。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:____________(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图2所示,则该化合物的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列达到平衡状态的标志是( )
4NO(g)+6H2O(g),下列达到平衡状态的标志是( )
A. 达到化学平衡时5v正(NH3)=4v逆(O2)
B. 单位时间内生成4 mol NO的同时,消耗4 mol NH3
C. NH3、O2、NO、H2O的物质的量之比满足4∶5∶4∶6
D. 恒温恒容,气体的密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。下列方框中对应的物质或有关叙述正确的是( )
![]()
A. Na2S4O6、H2O、Na2S2O3、Au2O、NaOH B. Na2S2O3、NaOH、Na2S4O6、Au2O、H2O
C. Na2S2O3、H2O、Na2S4O6、Au2O、NaOH D. 当1 mol Au2O3完全反应时,转移电子8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学利用下图所示装置(夹持及加热装置已略去,装置气密性良好)探究SO2的性质(实验前已事先除去装置中的空气)。请回答下列问题:

[查阅资料得知浓硫酸的沸点为338 ℃,酒精灯火焰的温度为400~500 ℃]
(1)仪器a的名称_________。
(2)装置D和F的作用是_________。
(3)加热时,装置A中反应的化学方程式为________。
(4)打开K1,关闭K2,加热装置A一段时间后,B中的现象是_____,当装置C中溶液由蓝色变为无色,由此推测所得无色溶液中的离子主要是H+、I- 和____;为了进一步实验证实了该过程中SO2已被氧化,该实验操作及现象是:_____。
(5)关闭K1,打开K2,用酒精灯加热装置A,观察到E中发生的现象是:有白色沉淀产生,白色沉淀的成分是_____,生成白色沉淀的原因可能是___(选填字母序号)。
a.SO2与BaCl2溶液反应生成了白色沉淀
b.BaCl2溶液与硫酸蒸气反应生成了白色沉淀
c.SO2溶于水生成的H2SO3被装置内的O2氧化生成H2SO4,再与BaCl2反应生成白色沉淀
(6)取A中产生的SO2气体通入足量双氧水中,然后加入足量BaCl2溶液,经过滤、洗涤、干燥得到4.66 g沉淀。据此推知SO2气体的体积为___mL(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com