
写出下列物质的电离方程式:
H2SO4 Ba(OH)2 Na2SO4 .
考点: 电离方程式的书写.
分析: 硫酸、氢氧化钡、硫酸钠都是强电解质,在溶液中完全电离,它们的电离方程式用等号,据此写出三者的电离方程式.
解答: 解:硫酸在溶液中完全电离出硫酸根离子和氢离子,电离方程式为:H2SO4=2H++SO42﹣;
氢氧化钡是强电解质,完全电离,电离方程式为:Ba(OH)2=Ba2++2OH﹣;
Na2SO4是盐,属于强电解质,在溶液中完全电离,其电离方程式为:Na2SO4=2Na++SO42﹣,
故答案为:H2SO4=2H++SO42﹣;Ba(OH)2=Ba2++2OH﹣;Na2SO4=2Na++SO42﹣.
点评: 本题考查电离方程式的书写,题目难度不大,试题侧重基础知识的考查,注意掌握强弱电解质的概念及电离方程式的书写方法,试题培养了学生灵活应用基础知识的能力.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
在给定条件的水溶液中能大量共存的粒子组是()
A. 无色透明的溶液:Fe3+、K+、OH﹣、NO3﹣
B. 与Al反应生成H2的溶液:Na+、Ma2+、NO3﹣、HCO3﹣
C. c(OH﹣)=1mol/L的溶液:K+、Ca2+、Cl﹣、H2SO3
D. CH3COOH:SO42﹣、Cl﹣、Cu2+、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
实验探究是体验知识的产生或形成过程的基本途径.下面是某同学探究实验报告的一部分,请填空:
实验名称:氯、溴、碘的氧化性强弱比较
实验药品:NaCl溶液、KBr溶液、KI溶液、氯水、溴水、四氯化碳
实验步骤 实验结论
①NaCl溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 氧化性从强到弱的顺序:氯、溴、碘
②KBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色
③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色
(1)完成该实验需用到的仪器是 ;
(2)CCl4在实验中所起的作用是 ;
(3)在实验②中四氯化碳层颜色变化过程为由 ;
(4)该同学的实验缺陷是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
用98%的浓硫酸(密度为1.84g/cm3)配制100mL 1 mol/L的稀硫酸.现给出下列仪器(配制过程中可能用到):①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是()
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)若要配制100mL0.1mol•L﹣1Na2SO4溶液,需称量Na2SO4的质量为1.4g.
(2)将2240mL氨完全溶于水配成100mL溶液,氨水中NH3的物质的量浓度为1mol•L﹣1.(不考虑NH3与H2O的反应)
(3)实验室里常用固体氯化铵与足量熟石灰加热制取氨.若需要2240mL(标准状况)氨,求至少需要氯化铵的质量.
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2(g)+3H2(g)⇌2NH3(g)达到平衡状态,下列说法中正确的是()
A. 该反应停止,N2和H2不再化合
B. N2、H2、NH3浓度不变
C. N2、H2、NH3浓度相等
D. N2、H2、NH3的物质的量之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某元素的阳离子R2+的核内中子数为n,质量数为A,则mg它的氧化物中所含电子的物质的量是()
A. 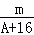 (A﹣n+8)mol B.
(A﹣n+8)mol B. 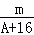 (A﹣n+10)mol
(A﹣n+10)mol
C. (A﹣n+2)mol D. 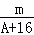 (A﹣n+6)mol
(A﹣n+6)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项中表达正确的是( )
|
| A. | 硫离子的核外电子排布式:1s22s22p63s23p6 |
|
| B. | N2的结构式::N≡N: |
|
| C. | NaCl的电子式: |
|
| D. | CO2的分子模型示意图: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com