BC
分析:A.标准状况下,水为液体,不能利用气体摩尔体积计算其物质的量;
B.同温同压下,体积之比等于分子数目之比;
C.O
3和O
2都由氧原子构成,48g为氧原子质量,根据n=

计算氧原子的物质的量,再根据N=nN
A计算氧原子的数目;
D.0.5 mol/LFe
2(SO
4)
3溶液中SO
42-的浓度为1.5mol/L,SO
42-的数目与溶液的体积有关.
解答:A.标准状况下,水为液体,不能利用气体摩尔体积计算其物质的量,11.2L水的物质的量远大于0.5mol,故A错误;
B.同温同压下,体积之比等于分子数目之比,故体积相同的氢气和氧气所含的分子数相等,故B正确;
C.O
3和O
2都由氧原子构成,48g为氧原子质量,氧原子的物质的量为
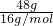
=3mol,氧原子的数目为3mol×N
Amol
-1=3N
A,故C正确;
D.0.5 mol/LFe
2(SO
4)
3溶液中SO
42-的浓度为1.5mol/L,1L该溶液中SO
42-的数目为1.5N
A,SO
42-的数目与溶液的体积有关,溶液的体积未知,不能确定硫酸根离子的数目,故D错误;
故选BC.
点评:本题考查常用化学计量的有关计算,难度不大,注意对公式的理解与灵活运用.

 计算氧原子的物质的量,再根据N=nNA计算氧原子的数目;
计算氧原子的物质的量,再根据N=nNA计算氧原子的数目;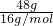 =3mol,氧原子的数目为3mol×NAmol-1=3NA,故C正确;
=3mol,氧原子的数目为3mol×NAmol-1=3NA,故C正确;
