
(1)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为________。
(2)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________。
(3)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________。
(4)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为________。
答案 (1)m<n (2)m>n
(3)m<n
(4)m>n
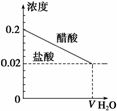
解析 (1)等浓度的盐酸和醋酸稀释过程的图象如右图所示:
分别加水稀释10倍后,两者的浓度仍相同,由于盐酸是强电解质,醋酸是弱电解质,盐酸的电离程度大于醋酸的电离程度,因此盐酸中的氢离子浓度大于醋酸中的氢离子浓度,因此有m<n。
(2)由上图可知,若两者稀释相同的倍数,则盐酸的pH小于醋酸的pH,若要两者的pH相等,则盐酸稀释的倍数大于醋酸稀释的倍数,故有m>n。
(3)
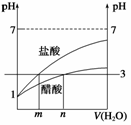
由于醋酸中存在电离平衡,在稀释过程中会继续电离出氢离子,其稀释过程中的图象如右图所示:
若稀释后溶液的pH都变成3(画一条平行于x轴的水平线)易得m<n。
(4)和上题相似画一张稀释图象即可,然后根据图象易得m>n。


科目:高中化学 来源: 题型:
下表中所示物质或概念间的从属关系符合右图的是
| X | Y | Z | |
| A. | 钠元素 | 主族元素 | 短周期元素 |
| B. | 电解质 | 化合物 | 纯净物 |
| C. | 氢氧化铁 | 胶体 | 分散系 |
| D. | 置换反应 | 氧化还原反应 | 放热反应 |

查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子一定能大量共存的是( )
A.在含有大量(AlO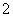 )的溶液中:NH
)的溶液中:NH 、Na+、Cl+、H+
、Na+、Cl+、H+
B.在强碱溶液中:Na+、K+、CO 、NO
、NO
C.在pH=12的溶液 中:NH 、Na+、SO
、Na+、SO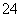 、Cl-
、Cl-
D.在c(H+)=0.1 mol·L-1的溶液中:K+、I-、Cl-、NO
查看答案和解析>>
科目:高中化学 来源: 题型:
对于重水D2O,在25℃时,KW=10-12,定义pD=-lgc(D+),则下列关于pD说法正确的是( )
A.25 ℃时,纯重水pD=7
B.25 ℃时,0.1 mol·L-1NaCl的重水溶液pD=pOD
C.25 ℃时,1 mol·L-1DCl的重水溶液pD=0,pOD=14
D.25 ℃时,0.1 mol·L-1NaOD的溶液中pD=10
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是一种可再生燃料。在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示。
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示。

(1)该反应的△H 0 (填>、<或=)
(2)300℃时,0-t1 min内 CH3OH的平均生成速率为
(3)若要提高甲醇的产率,可采取的措施有_________ 。(填字母)
A.缩小容器体积 B.降低温度
C.升高温度 D.使用合适的催化剂
E.甲醇从混合体系中分离出来
(4)300℃时,CO、H2的起始物质的量分别为2mol和3mol,若图中n1数据为0.5mol,试计算300℃下,该反应的平衡常数(写出计算过程,保留两位有效数字)
(5)工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,若有440g CO2与H2恰好完全反应生成甲醇和水,放出495kJ的热量,试写出该反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验,反应物用量和反应停止的时间数据如下表:
|
时间 H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
请回答下列问题:
(1)盛装双氧水的化学仪器名称是 。
(2)如何检验该套装置的气密性 。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_______________________________________。(提示:H2O2的密度可认为近似相等)。
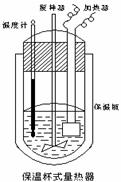 (Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
(Ⅱ)在如图所示的量热计中,将100mL 0.50mol·L-1CH3COOH溶
液与100mL0.55mol·L-1NaOH 溶液混合,温度从25.0℃升高到27.7℃。已知量热计的热容常数(量热计各部件每升高1℃所需的热量)是
150.5J·℃-1生成溶液的比热容为4.184J·g-1·℃-1,溶液的密度均近似
为1g·mL-1。
(1)试求CH3COOH的中和热△H= 。
(2)CH3COOH的中和热的文献值为56.1KJ· mol-1,则请你分
析在(1)中测得的实验值偏差可能的原因 。
(3)实验中NaOH过量的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+x B(g) 2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
2 C(g)达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是:
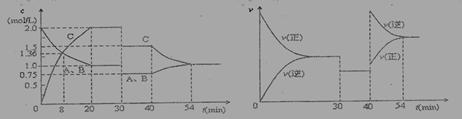
A.30min时降低温度,40min时升高温度
B.30min时,向容器内再充入一定量的C,重新达到平衡时,A的体积分数不变
C.反应方程式中的x=1,正反应为吸热反应
D.8min前,C的平均反应速率为0.08 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
关于蛋白质的叙述错误的是( )
A.浓HNO3溅在皮肤上,使皮肤呈黄色,是由于浓HNO3和蛋白质发生了颜色反应
B.蛋白质溶液中加入饱和(NH4)2SO4溶液,蛋白质析出,再加水也不溶解
C.蛋白质水解的最终产物是氨基酸
D.高温灭菌的原理是加热后使蛋白质变性,从而使细菌死亡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com