
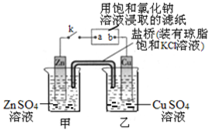
| A、Zn电极上发生还原反应 |
| B、片刻后盐桥中的Cl-向乙装置中移动 |
| C、片刻后在a点滴加酚酞观察到滤纸变红色 |
| D、片刻后在b点滴加淀粉碘化钾溶液观察到滤纸无变化 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
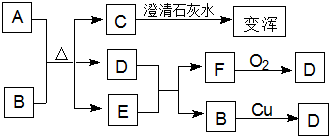
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液中Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全Ba2++OH-+H++SO42-=BaSO4↓+H2O |
C、服用阿司匹林过量出现水杨酸( )反应,可静脉注射碳酸氢钠溶液: )反应,可静脉注射碳酸氢钠溶液: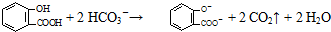 |
| D、向FeI2溶液中加少量氯水 2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试管 | 盐酸浓度 | 温度 | 锌的状态 |
| A | 0.5mol?L-1 | 20℃ | 块状 |
| B | 0.5mol?L-1 | 20℃ | 粉末状 |
| C | 0.5mol?L-1 | 35℃ | 粉末状 |
| D | 18mol?L-1 | 35℃ | 粉末状 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
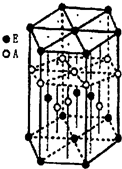 某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为l4:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)d n+6nsl,回答下列问题.
某配位化合物为深蓝色晶体,由原子序数由小到大的A、B、C、D、E五种元素构成,其原子个数比为l4:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n-1)d n+6nsl,回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com